- Medizintechnik-Folgenabschätzung
-
Health Technology Assessment (HTA) bzw. Medizintechnik-Folgenabschätzung bezeichnet einen Prozess zur systematischen Bewertung medizinischer Technologien, Prozeduren und Hilfsmittel, aber auch Organisationsstrukturen, in denen medizinische Leistungen erbracht werden. Untersucht werden dabei Kriterien wie Wirksamkeit, Sicherheit und Kosten, jeweils unter Berücksichtigung sozialer, rechtlicher und ethischer Aspekte. Das Ergebnis einer HTA-Studie wird in der Regel als HTA-Bericht veröffentlicht. Dieser soll primär als Entscheidungshilfe bei gesundheitspolitischen Fragestellungen dienen. Dazu gehört unter anderem die Übernahme von Innovationen in den Leistungskatalog der Gesetzlichen Krankenversicherung durch den Gemeinsamen Bundesausschuss (G-BA).
Inhaltsverzeichnis
Historie und Entwicklung
Mit randomisierten kontrollierten Studien existieren seit den 1930er Jahren erstmals wissenschaftliche Hilfsmittel zur Bestimmung von Sicherheit und Wirksamkeit von Behandlungen. Der Begriff Technology Assessment (Technikfolgenabschätzung) wird zum ersten Mal im Jahr 1965 im US Kongress erwähnt und umfasst Transportwesen, Verkehr, Energie, Ernährung, Rüstung und Raumfahrt [1]. Immer neue medizinische Entwicklungen bringen die Notwendigkeit mit sich, diese Überlegungen und Analysen auch auf den Gesundheitssektor auszuweiten, insbesondere weil die finanziellen Ressourcen zunehmend begrenzt sind. Zwischen 1970 und 1980 entstehen erste Konzepte zur Bewertung von Technologien im Gesundheitswesen, vor allem mittels Fallstudien.
Das erste Gremium, das sich konkret mit Technologiebewertungen im Gesundheitswesen auseinandersetzt, ist das "Congressional Office of Technology Assessment" (OTA), welches 1972 in den USA gebildet wird. Seine Aufgabe ist die Sammlung von entsprechenden Daten und die Information der Politiker[2]. Ab Mitte der 1980er Jahre führen auch europäische Regierungen derartige nationale Programme ein - zunächst in Schweden (1987) und den Niederlanden (1988), etwas später in Frankreich (1990) und Großbritannien (1991)[3].
In den folgenden Jahren findet eine stetige Internationalisierung und Vernetzung der HTA-Einrichtungen statt. 1985 wird die International Society of Technology Assessment in Health Care (ISTAHC) als wichtigstes Forum für HTA-Fragen gegründet. Das International Network of Agencies for Health Technology Assessment (INAHTA) fördert seit 1993 die internationale Zusammenarbeit und den Informationsaustausch derartiger Einrichtungen. Seitdem erfolgt eine systematische Standardisierung und Weiterentwicklung der Methoden beispielsweise durch Buchreihen mit HTA-Berichten und große Literaturverzeichnisse wie die der Cochrane Collaboration.
In Deutschland fördert die Politik die HTA-Entwicklung maßgeblich. 1994 wird das Büro für Technikfolgenabschätzung beim Deutschen Bundestag gegründet. Im Rahmen einer Förderinitiative des Bundesministeriums für Gesundheit wird 1995 ein HTA-Programm eingerichtet, welches auch im SGB V verankert wird. 2000 übernimmt das Deutsche Institut für Dokumentation und Information (DIMDI, dem BMG nachgeordnet) das deutsche HTA-Programm. Hierzu wird die Deutsche Agentur für Health Technology Assessment des DIMDI (DAHTA@DIMDI) gegründet. Als neueste Einrichtung mit Bezug zu HTA erarbeitet das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) seit 2004 Gutachten zu gesundheitspolitischen Problemen und Bewertungen von evidenzbasierten Leitlinien.
Vorgehen in Deutschland
Zielsetzung
"Die in einem HTA-Bericht bereitgestellten Informationen über mögliche Auswirkungen von Technologien und Strukturen auf die Gesundheit bzw. Gesundheitsversorgung dienen letztendlich der Optimierung des Gesundheitswesens. Die Informationen über medizinische, ökonomische und andere Aspekte sollen insbesondere gesundheitspolitische Entscheidungen unterstützen und Handlungs- und Entscheidungsbedarf aufzeigen."[4]
HTA Prozesse
Bei der Durchführung von HTA nehmen verschiedenste Interessengruppen aus dem Gesundheitswesen und der Gesundheitspolitik teil. In Deutschland sind im wesentlichen zwei Institutionen mit HTA Berichten beschäftigt. Das Deutsche Institut für Dokumentation und Information (DIMDI), hier speziell die Deutsche Agentur für Health Technology Assessment (DAHTA@DIMDI), beauftragt umfassende Berichte zu HTA. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) veröffentlicht Berichte, die zwar nicht konkret als HTA-Berichte bezeichnet werden, allerdings werden Teilaspekte des Health Technology Assessment hier abgedeckt.
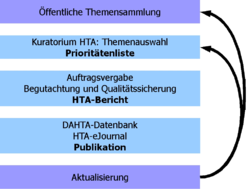
Vorgehensweise bei DAHTA@DIMDI
"Die DAHTA initiiert, begleitet und publiziert HTA-Berichte in Zusammenarbeit mit der Öffentlichkeit (Themenvorschläge), dem Kuratorium HTA (Themenauswahl) und den Autoren (Themenbearbeitung). Das geschieht in einem transparenten und standardisierten Prozess, der sich eng an international akzeptierte Entwicklungen der HTA-Methodik anlehnt."[5]
Ein HTA-Zyklus beginnt immer mit der Themenfindung. Jeder Interessierte kann Themen für potenzielle HTA-Berichte bei DAHTA@DIMDI vorschlagen, die in einer dafür vorgesehenen Datenbank abgelegt werden. Die Themen werden von verschiedenen Personengruppen wie z.B. Ärzten, Apothekern, Pflegepersonal, Verwaltungspersonal oder auch Patienten eingereicht. Sie stammen aus verschiedenen Bereichen, die ärztliche Behandlung, Therapie, Rehabilitation, Pflege und weitere Disziplinen aus dem Gesundheitswesen betreffen.
Die gesammelten Vorschläge werden zweimal jährlich von DAHTA@DIMDI für das Kuratorium HTA (Vertreter aus den Entscheidungsgremien des Gesundheitswesens: G-BA, Kassenärztliche Vereinigungen, Krankenkassen, Versicherungen etc.) aufbereitet und zur Priorisierung vorgeschlagen. Hierzu werden zuvor sogenannte Machbarkeitsanalysen durchgeführt. Diese bestehen einführend aus einem medizinischen Text, um entsprechendes Hintergrundwissen zu geben; Hiernach erfolgt eine Literaturrecherche in den wichtigsten medizinischen Datenbanken nach festgelegten Methoden und mit strenger Dokumentation, um zu sehen, ob es genug Publikationen zu dem Thema gibt. Außerdem wird geprüft, ob die Fragestellung detailliert genug gefasst wurde. Die Themen werden dann mithilfe der Delphi-Methode (spezielles statistisches Bewertungsverfahren) priorisiert, bei der die Mitglieder des Kuratoriums mehrmals schriftlich befragt werden. Zur endgültigen Themenfestlegung treffen sie sich persönlich. Als Ergebnis dieses Vorgangs stehen die Themen aus der Datenbank fest, für die dann tatsächlich ein HTA-Bericht erstellt wird.
Damit beauftragt DAHTA@DIMDI qualifizierte Wissenschaftler. Die Erstellung eines HTA-Berichts folgt Standard Operating Procedures (SOP). Dadurch ist eine hohe Qualität, Transparenz und Nachprüfbarkeit der einzelnen Arbeitsschritte gewährleistet. Die Wissenschaftler bewerten die Technologie nach experimenteller Wirksamkeit (engl. «efficacy»), Wirksamkeit unter Alltagsbedingungen (engl. «effectiveness») und Kosteneffizienz (engl. «efficiency») unter Beachtung sozialer, rechtlicher und ethischer Aspekte. Zusätzlich werden HTA-Berichte einem internen und externen Peer-Review-Verfahren unterzogen. Fertiggestellte HTA-Berichte werden kostenfrei zur Verfügung gestellt [6]. Nach Abschluss eines HTA-Berichts kann auf Antrag jederzeit ein Update erfolgen.
Vorgehensweise bei IQWiG
Die Auftragsvergabe für einen IQWiG-Bericht erfolgt durch den G-BA oder das Bundesgesundheitsministerium. Der Auftrag wird in Abstimmung mit dem Auftraggeber konkretisiert. Dabei werden grobe Zielkriterien definiert und gegebenenfalls Expertenmeinungen mit einbezogen. Um patientenbezogene Zielkriterien sinnvoll festlegen zu können, werden während des Prozesses regelmäßig Betroffene, Patientenvertretungs- und/oder Verbraucherorganisationen befragt und mit einbezogen.
Im nächsten Schritt wird ein Berichtsplan erstellt. Er beinhaltet zum Beispiel die Definition und Festlegung der genauen wissenschaftlichen Fragestellung einschließlich der Zielkriterien, Ein- und Ausschlusskriterien der für die Nutzenbewertung zu verwendenden Informationen oder eine Darlegung der projektspezifischen Methodik der Beschaffung und Bewertung dieser Informationen. Darüber hinaus wird auch ein Zeitplan bis zur Publikation des Abschlussberichts festgehalten.
Bei dieser Ausarbeitung können auch externe Sachverständige herangezogen werden. Wenn der Berichtsplan fertiggestellt ist wird er für ein internes Review dem Steuergremium vorgelegt. Anschließend wird er dem Auftraggeber und dem Kuratorium zugeleitet und veröffentlicht.
Innerhalb der nächsten vier Wochen werden schriftliche Stellungnahmen zum Berichtsplan eingeholt. Dieser Prozess wird als Anhörung bezeichnet. Hierin sind Angaben zu den Ein- und Ausschlusskriterien besonders wichtig. Sollte die Anhörung Änderungen nach sich ziehen, so werden diese in einem Amendment festgehalten und publiziert. Erst wenn diese Schritte durchgeführt sind, beginnt die Informationsbeschaffungen und wissenschaftliche Bewertungen der Technologie.
Die Ergebnisse werden im Vorbericht festgehalten. Auch externe Sachverständige können Teile des Vorberichts erarbeiten. Der Vorbericht wird wiederum dem Steuergremium zum internen Review vorgelegt und anschließend externen Gutachtern, dem Auftraggeber und dem Kuratorium zugeleitet. Zusätzlich wird dieser auch im Internet veröffentlicht.
Ähnlich wie beim Berichtsplan wird auch hier eine Anhörung zum Vorbericht durchgeführt. Hier werden auch eventuell bereits vorhandene Amendments mit berücksichtigt.
Der sich daran anschließende Abschlussbericht basiert auf dem Vorbericht und beinhaltet die "Bewertung der wissenschaftlichen Erkenntnisse unter Berücksichtigung der Ergebnisse der schriftlichen Anhörung"[7]. Er stellt das Ende der Auftragsbearbeitung dar und wird auch dem Steuergremium zum internen Review vorgelegt.
Sollten neue noch nicht berücksichtigte Evidenzen auftreten, können diese beurteilt werden und unter Umständen kann eine Aktualisierung (Neubeauftragung durch den Auftraggeber) eingeleitet werden.[8]
HTA Berichte
Seit 1999 veröffentlicht der G-BA die im Prozess gefundenen Ergebnisse als „Zusammenfassende Dokumentationen“. Dabei unterstützen ihn Institutionen wie das DIMDI und das IQWiG. Externe HTA-Berichte spielen in Deutschland nur eine untergeordnete Rolle[9], können aber zum Gegenstand des GBA-Beratungsverfahrens werden. Generell plant der G-BA vermehrt die Aufbereitung von gesundheitsökonomischen Daten oder Modellierungen externer Einrichtungen wie HTA-Gruppen, Auftragsforschungsinstitute oder gesundheitsökonomisch aktiven Gruppen zu verwenden. Im Allgemeinen besitzen die „Zusammenfassenden Dokumentationen“ folgende Struktur:
- Zusammenfassung / Abstract
- Gesetzlicher/gesundheitspolitischer Hintergrund
- Wissenschaftliche Einleitung
- Forschungsfragen
- Methodik der Verfahrensbewertung
- Ergebnisse
- Diskussion
- Fazit und Beschlussempfehlung/Schlussfolgerungen/Ausblick
- Anhänge
Bedeutung und Nutzen von HTA
Gesundheitspolitik
Das Ziel der Politik war es beim Aufbau einer HTA-Berichtsdatenbank eine wissenschaftliche Grundlage für politische und gesetzliche Entscheidungen zu liefern. Abhängig vom zeitlichen Rahmen können bestimmte HTA Berichte zunächst in Auftrag gegeben werden, um dann als Entscheidungsgrundlage zu dienen. Aufgrund des langwierigen Erstellungsprozesses wird es schwierig HTA-Berichte zur Verfügung zu stellen, wenn die politische Entscheidung in einem engen zeitlichen Rahmen getroffen muss. Es sei denn, ein entsprechender Bericht ist bereits in der Datenbank verfügbar.
In Dänemark, wo bereits längere Zeit HTA-Berichte durchgeführt werden, wurde in einer öffentlichen Sitzung des Gesundheitsausschusses des Parlaments die Bedeutung, der Nutzen und der mögliche Missbrauch von HTA diskutiert. Daraus ließen sich einige Eindrücke[10] gewinnen: HTA kann als ein brauchbares Mittel zur Prioritätensetzung gesehen werden, man kann aber nicht bei jeder Fragestellung eine eindeutige Antwort erwarten. Darüber hinaus forderten Politiker teilweise trotzdem noch zusätzliche und objektive Beratung.
Relevante Gesetze in Deutschland
- GKV-Gesundheitsreformgesetz 2000 - Artikel 19: Gesetz über ein Informationssystem zur Bewertung medizinischer Technologien[11]
- Dieser Artikel überträgt "dem Deutschen Institut für Medizinische Dokumentation und Information (DIMDI) in Köln die Errichtung und den Betrieb eines datenbankgestützten Informationssystems für die Bewertung der Wirksamkeit und der Effektivität sowie der Kosten medizinischer Verfahren und Technologien". [12]
- SGB V - § 35b - Bewertung des Nutzens und der Kosten von Arzneimitteln[13]
- Dieser Artikel befasst sich mit der Beauftragung des IQWiG, Medikamente nach Nutzen und Kosten-Nutzen-Verhältnis zu beurteilen und somit G-BA eine Empfehlung zu liefern.
- SGB V - § 137c - Bewertung von Untersuchungs- und Behandlungsmethoden im Krankenhaus[14]
- Dieser Artikel ermöglicht es Untersuchungs- und Behandlungsmethoden im Krankenhaus vom G-BA unter dem Gesichtspunkt bewerten zu lassen, ob für eine ausreichende, zweckmäßige und wirtschaftliche Versorgung der Versicherten diese Methode notwendig ist. Ist dies nicht der Fall, kann eine entsprechende Richtlinie erlassen werden, sodass die Krankenkassen diese Methode nicht mehr finanzieren müssen.
- SGB V - §139a - Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen[15]
- Dieser Artikel beschreibt die Gründung und die Aufgaben des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen.
- SGB V - §139b - Aufgabendurchführung[16]
- Es werden die grundsätzlichen Schritte einer Aufgabendurchführung, von der Vergabe bis zum Ergebnis, beschrieben.
- GO-BT (Geschäftsordnung Bundestag) - §56a - Technikfolgenanalyse[17]
- Beschreibt das Recht des Ausschusses für Forschung, Technologie und Technikfolgenabschätzung eine Technikfolgeanalyse in Auftrag zu geben.
Leistungserbringer
HTA kann den Leistungserbringern ähnlich wie der Gesundheitspolitik als eine Art Entscheidungsunterstützung oder Hilfe zur Entwicklung von Vorgehensweisen bei der Behandlung von Patienten dienen. Allerdings werden HTA Berichte häufig unter ökonomischen Aspekten erstellt. Folge kann unter Umständen die Streichung einer "Technologie" aus dem Leistungskatalog der Krankenkassen sein. Dies schränkt die Bandbreite der Behandlungsmethoden für den Leistungserbringer ein. Da jeder Patient ein Individuum ist, gibt es durchaus Fälle, die auf Behandlungen positiv reagieren, obwohl diese als nicht wirkungsvoll und nicht kosteneffizient eingestuft sind. HTA (und auch EBM) führen zu einer besseren Planbarkeit und Kostenabschätzung, abstrahieren aber von einzelnen Individuen. Die Leistungserbringer werden zunehmend zu Bearbeitern von Checklisten.
International
In den vergangenen zwei Dekaden waren die meisten industrialisierten Länder zunehmend über die rasche technologische Entwicklung und die Eskalation der Kosten für die Bereitstellung von Dienstleistungen im Gesundheitsbereich besorgt. Diese Tatsache führte auch zu steigendem Interesse an der Anwendung des HTA-Verfahrens für die Beurteilung der medizinischen Technologien. Heutzutage werden HTA-Berichte beinahe in allen industrialisierten Ländern verfasst und zum oben genannten Zweck benutzt. Der Einfluss dieser Berichte auf die politischen Entscheidungen im Gesundheitswesen ist von Land zu Land unterschiedlich, dennoch wurde die Notwendigkeit dieses Vorgehens überall erkannt. Von den G-7-Staaten scheinen Kanada, Vereinigtes Königreich und Frankreich diejenigen Länder zu sein, in den die Erstellung der HTA-Berichte am besten organisiert ist (siehe [18]). Im Vereinigten Königreich ist eine große Anzahl an HTA-Agenturen vorhanden, die den Entscheidungsträgern bzw. dem medizinischen Personal zu Rate stehen. In Frankreich ist die HTA-Agentur-Landschaft eher homogen. Die wenigen für HTA verantwortlichen Institutionen scheinen aber einen großen Einfluss auf die politische Entscheidungen zu haben.
EUnetHTA
Seit 2006 koordiniert das EU-Projekt EUnetHTA (European network for Health Technology Assessment) [19] den HTA Prozess in 27 europäischen Ländern. Das Ziel dieser Einrichtung ist die Vernetzung von regionalen und nationalen HTA Institutionen, Forschungseinrichtungen und Gesundheitsministerien, um einen effektiven Austausch von Informationen und Unterstützung zu erleichtern.
HTA in Großbritannien
Ziel des HTA Programms des National Institute for Health Research UK (NIHR) ist es, unabhängige Studien über die Wirksamkeit von verschiedenen Behandlungen im Gesundheitswesen zu entwickeln. Jedes Jahr werden ca. 50 neue Studien in renommierten Fachzeitschriften veröffentlicht.
Neue Themen für das HTA Programm werden folgendermaßen identifiziert bzw. vorgeschlagen:
- Externe Institute und Organisationen, die nicht direkt mit dem NIHR zusammenarbeiten, können Themenvorschläge einreichen. Es existieren diesbezüglich „arrangements“.
- Jeder Bürger kann über einen „open channel“ im Internet Themen vorschlagen.
- Vorschläge der „National Specialist Commissioning Advisory Group“, „National Service Frameworks“ und dem „National Institute for Health“ sowie „Clinical Excellence“.
Dreimal jährlich werden die Themen durch einen Ausschuss bewertet. Er kann hierbei weitere Experten zu Rate ziehen. Das Ergebnis ist ein „panel paper“, einem Plan der weiteren Vorgehensweise. Eine Liste dieser Berichte ist über die Homepage des NIHR abrufbar.
Entsprechend der "panel papers" werden Forschungsprojekte durch folgende Ausschüsse eingeleitet:
- Das HTA Commissioning Board (HTACB)
- Das HTA Clinical Trials Assessment Board (HTACTAB)
- HTA Assessment Boards für spezifische Themengebiete
- Das NIHR Methodology Panel[20][21]
HTA in Frankreich
Um die Qualität im Gesundheitswesen zu erhöhen, wurden in Frankreich seit 1990 eine Reihe von verschiedenen Institutionen gegründet, die zwar dem Gesundheitsministerium Berichte ablegen müssen, aber für Ihre Kunden selbst verantwortlich sind.
Die wichtigste Institution ist HAS, Haute Autorité de Santé [22], welche aus ANAES (Agence Nationale d'Accreditation et d' Evaluation en Santé) entstanden ist. Es handelt sich hierbei nicht um eine staatliche Behörde, sondern um eine unabhängige öffentliche Institution mit Finanzhoheit. Ziel dieser Behörde ist die Optimierung von Qualität und Sicherheit durch Evaluierung im Bereich von klinischer Praxis und Bevölkerungsgesundheit. Zu diesem Zweck wird auch auf das Instrument der HTA Berichte zurückgegriffen. Des Weiteren werden HTA Berichte auch vom Institut National de la Santé veröffentlicht (siehe [23]).
Auf der Seite der privaten Institutionen gibt es die folgenden: Comité d’Évaluation et de Diffusion des Innovations Technologiques (CEDIT) der Krankenhäuser in Paris, Société Française pour l’Évaluation des Soins et des Technologies Médicales (SOFESTEC).
Im Rahmen der Zusammenarbeit im Datenbank-Bereich mit Deutschland stellt INSERM - Institut nationale de la Santé et de la Recherche médicale- dem DIMDI die französische Übersetzung des MeSH zur Verfügung.
HTA in Kanada
Die Canadian Agency for Drugs and Technologies in Health (CADTH [24]), früher die Canadian Coordinating Office for Health Technology Assessment (CCOHTA), und das Institute of Health Economics (IHE [25]) sind die nationalen HTA-Agenturen in Kanada. Darüber hinaus existieren seit den späten 1980er Jahren mehrere HTA-Einrichtungen in den Provinzen (z.B.: AETMIS - Agence d´Évaluation des Technologies et des Modes d´Intervention en Santé [26], MAS - Medical Advisory Secretariat [27]) und in einzelnen Instituten (Krankenhäuser, Universitäten) des ganzen Landes. Diese Agenturen haben durch ihre regionale Beschränkung oft nur Einfluss auf die politischen Entscheidungsträger der jeweiligen Provinz oder des Institutes. Die Themen der Berichte werden von verschiedenen Personengruppen vorgeschlagen. Zum einen von den Vertretern des kanadischen Gesundheitsministerium in den Agenturen, zum anderen von politischen Entscheidungsträgern oder von der Öffentlichkeit.
HTA in den USA
In den USA wird die Durchführung von Health Technology Assessments im Rahmen des Gesundheitswesens durch das "United States Department of Health and Human Services" betreut. Entsprungen ist das Technology Assessment im Gesundheitswesen durch die Einführung des im Kongress eingeführten Office of Technology Assessment.
In den USA werden HTA-Berichte von einer Vielzahl von Organisationen durchgeführt. Zu diesen gehören unter anderem die Aufsichtsbehörden der einzelnen Bundesstaaten, Auftragsgeber aus Regierung und Privatwirtschaft, Krankenhausverbünde und Netzwerke im Gesundheitswesen, akademische Gesundheitszentren u.v.m.[28])
Maßgeblich beteiligt an der Initiierung von HTA Untersuchung sind die folgenden Institute der amerikanischen Gesundheitsbehörde "United States Department of Health and Human Services" [29]:
- AHRQ Agency for Healthcare Research and Quality
- CMS Centers for Medicare & Medicaid Services
- NIH National Institute of Health (The Nations Medical Research Agency)
Detaillierte Informationen über die Belange des HTA in den USA sind auf der dem NIH unterstellten
- National Library of Medicine bzw. dem
- National Information Center on Health Service Research and Health Care Technology (NICHSR)
[30] zu entnehmen.
Kritik und Grenzen
HTA ist als Steuerungsinstrument zu langsam, zu teuer und nicht zielorientiert.
HTA dauert zu lange, und es werden meistens nur Technologien bewertet, die schon eingesetzt werden. Zukünftige Technologien werden nicht bewertet. Hier kommt es jedoch schon zu einem Umbruch und es werden sogenannte Kurz HTA angefertigt, welche neue Technologien bewerten.
Studien als Grundlage für HTA
Sind Studien die Grundlage für HTA, ist der Erkenntnisgewinn abhängig vom Untersuchungsgegenstand wie z.B. eine wissenschaftliche Hypothese, eine wissenschaftliche Fragestellung und der Qualität des Studiendesigns. Ein weiterer Punkt ist, dass Studien in der Regel nicht zum Zweck der Entscheidungsfindung durchgeführt werden, sondern einen wissenschaftlichen Hintergrund haben. Aus diesen Grund ist es nicht immer einfach die Ergebnisse für HTA einzusetzen. Außerdem stammen die gewonnenen Ergebnisse meist aus Studien mit ausgesuchtem Patientenklientel und werden unter klinischen Bedingungen durchgeführt, wodurch eine Verallgemeinerung der Ergebnisse nicht immer möglich ist, da die Alltagssituation sowie der Versorgungskontext unzureichend abgebildet und berücksichtigt werden.
Evidenz ist nicht gleichmäßig verteilt (Orphan diseases).
HTA-Berichte entstehen unter anderem auch aus Forschungsberichten, diese wiederum in verschiedenen Bereichen wie der Krebsforschung, Diabetesforschung, usw.. Da in manchen Forschungsgebieten, wie z.B. bei Malaria und Gelbfieber, wenig Forschungsaufwand betrieben wird, gibt es dort nur wenige Technologiebewertungen, so dass keine HTA-Berichte angefertigt werden können.
Kein Standard für HTA-Organisationen
Jede Organisation kann HTA-Berichte nach ihren eigenen Kriterien anfertigen und veröffentlichen. Dadurch können unterschiedliche Organisationen bei einem Thema zu völlig unterschiedlichen Ergebnissen kommen.
Sozialer und ethischer Aspekt von HTA
„HTA kann eine Hilfestellung für Entscheidungsträger sein.“ Soweit die Theorie. In der Praxis etabliert sich HTA häufig nahezu ausschließlich als Instrument zur ökonomischen Bewertung von Arzneimitteln. Soziale und ethische Aspekte, aber auch die Wirksamkeit unter Alltagsbedingungen werden viel zu häufig außer Acht gelassen. So kann etwa schon die orale Applikationsform eines Medikaments gegenüber einer subkutanen Injektion wesentliche Alltagserleichterungen für PatientInnen bringen – in eine HTA-Bewertung fließen diese Überlegungen kaum ein. Das liegt allerdings auch daran, dass vielfach zum Zeitpunkt der Zulassung eines Medikaments eine Bewertung durch Health Technology Assessment aufgrund der Datenlage schwierig ist. Zu diesem Zeitpunkt liegen häufig nur Daten zur Efficacy, also zur Wirksamkeit unter Studienbedingungen, vor. Viel aussagekräftiger für die Praxis sind dagegen Daten, die die Effectiveness, also die Wirksamkeit unter Alltagsbedingungen, zeigen. „Derzeit besteht bei jedem Assessment ein Mangel an guten Daten als Entscheidungsgrundlage“, kritisierte Dr. Marcus Müllner, Bereichsleiter der AGES PharmMed 2: „Das „echte Leben“ bleibt vorerst in der Zulassung von Medikamenten weitestgehend ausgespart.“[31]
Weitere Informationen zu Kritik befinden sich unter [32] und [33]
Literatur
- Siebert U, Mühlberger N, Behrend C. et al. PSA-Screening beim Prostatakarzinom. Systematischer gesundheitsökonomischer Review. Entwicklung und Anwendung eines Instrumentariums zur systematischen Bewertung gesundheitsökonomischer Studien. NOMOS Verlagsgesellschaft; Auflage: 1. Aufl. (11. April 2001). ISBN 3-7890-7165-X
- Leidl R, Schulenburg JM, Wasem J. Ansätze und Methoden der ökonomischen Evaluation. Nomos (1999). ISBN 3-7890-6355-X
- Perleth M (2003) Evidenzbasierte Entscheidungsunterstützung im Gesundheitswesen. Konzepte und Methoden der systematischen Bewertung medizinischer Technologien (Health Technology Assessment) in Deutschland. Berlin: WiKu-Verlag.
- Busse R et al. 2002: Best practice in undertaking and reporting HTA, Int J Technol Assess Health Care 18(2): 321-422.
- Perleth M et al. Health Technology Assessment. Konzepte, Methoden, Praxis für Wissenschaft und Entscheidungsfindung. Medizinisch Wissenschaftliche Verlagsgesellschaft, Berlin, 2008, ISBN 978-3-939069-22-5
Journale
- eJournal des Deutschen Instituts für Medizinische Dokumentation und Information (DIMDI)
- International Journal of Technology Assessment in Health Care
Siehe auch
- Evidenzbasierte Medizin
- Cochrane Collaboration
- Technikfolgenabschätzung / Technology Assessment
- Gesundheitsökonomie
Weblinks
- Deutsche Agentur für Health Technology Assessment des DIMDI (DAHTA@DIMDI)
- Information zu Health Technology Assessment auf den Webseiten des Deutschen Cochrane Zentrums
- European network for Health Technology Assessment (EUnetHTA)
- HTAi -- An International Society for the Promotion of Health Technology Assessment
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
- International Network of Agencies for Health Technology Assessment (INAHTA)
Einzelnachweise
- ↑ http://www.versorgungsforschung.nrw.de/content/e67/e106/e938/e1006/object1009/VortragPerleth.pdf
- ↑ http://www.rzbd.haw-hamburg.de/hta/HTA/HTA.html
- ↑ http://www.itas.fzk.de/deu/tadn/tadn011/perl01b.htm
- ↑ http://www.egms.de/de/meetings/hta2007/07hta05.shtml
- ↑ http://www.egms.de/de/meetings/hta2007/07hta05.shtml
- ↑ Siehe www.dimdi.de und www.egms.de
- ↑ Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen, "Methoden", Version 2.0, Stand 19. Dezember 2006, S.101-104 Z.24-25 http://iqwig.de/methoden.428.html
- ↑ Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen, "Methoden", Version 2.0, Stand 19. Dezember 2006 http://iqwig.de/methoden.428.html
- ↑ Innovationsservice der Kassenärztlichen Bundesvereinigung (KBV): neue Chance für HTA in Deutschland, R. Schiffner, herausgegeben von der KBV
- ↑ H. Sigmund, F.B. Kristensen. Hilft HTA dem Gesundheitswesen und der Gesundheitspolitik? Erfahrungen einer etablierten HTA-Institution – das dänische Zentrum für Evaluation und HTA. Bundesgesundheitsblatt. 9-2001;44:855–856
- ↑ Bundesgesetzesblatt
- ↑ W. Stöber (DIMDI). Health Technology Assessment als Grundlage evidenzbasierter Entscheidungsfindung in der Gesundheitspolitik. Bundesgesundheitsblatt. 9-2001;44:855–856
- ↑ http://www.gesetze-im-internet.de/sgb_5/__35b.html
- ↑ http://www.gesetze-im-internet.de/sgb_5/__137c.html
- ↑ http://www.gesetze-im-internet.de/sgb_5/__139a.html
- ↑ http://www.gesetze-im-internet.de/sgb_5/__139b.html
- ↑ http://bundesrecht.juris.de/btgo_1980/__56a.html
- ↑ K. Kargus, C. Roehrig: Health Technology Assessment in Canada and the G-7 Countries: A comparative analysis of the role of HTA agancies in the decision making process. Seite 46
- ↑ http://eunethta.net
- ↑ http://www.hta.nhsweb.nhs.uk/
- ↑ http://www.hta.nhsweb.nhs.uk/about/probity.pdf
- ↑ http://www.has-sante.fr
- ↑ "Health Technology Assessment in Canada and the G-7 Countries: A comparative analysis of the role of HTA agancies in the decision making process." by C. Roehrig and K. Kargus
- ↑ http://www.cadth.ca
- ↑ http://www.ihe.ca
- ↑ http://www.aetmis.gouv.qc.ca/site/accueil.phtml
- ↑ http://www.health.gov.on.ca/english/providers/program/mas/mas_about.html
- ↑ http://www.bcbs.com/betterknowledge/tec/
- ↑ http://www.hhs.gov
- ↑ HTA 101: Introduction to Health Technology Assessment http://www.nlm.nih.gov/nichsr/hta101/ta101_c1.html Clifford S. Goodman, Ph.D. The Lewin Group January 2004
- ↑ Kritik von Dr. Marcus Müllner, Bereichsleiter der AGES PharmMed
- ↑ Bamford J et al. Current practice, accuracy, effectiveness and cost-effectiveness of the school entry hearing screen.Health Technol Assess. 2007 Aug;11(32):1-168, iii-iv.
- ↑ Mason A et al. A systematic review of the effectiveness and cost-effectiveness of different models of community-based respite care for frail older people and their carers.Health Technol Assess. 2007 Apr;11(15):1-157, iii.
Wikimedia Foundation.