- Methylmalonyl-CoA-Mutase
-
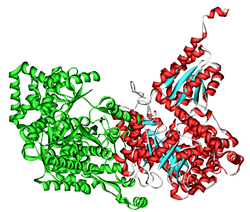
Humane L-Methylmalonyl-CoA-Mutase Bändermodell nach PDB 3BIC Vorhandene Strukturdaten: 1req, 3bic Masse/Länge Primärstruktur 718 Aminosäuren Sekundär- bis Quartärstruktur Homodimer Kofaktor Adenosylcobalamin (Vitamin B12) Bezeichner Gen-Namen MCM; MUT; MUTA Externe IDs OMIM: 609058 UniProt: P22033 MGI: 97239 Enzymklassifikation EC, Kategorie 5.4.99.2 Mutase Reaktionsart Isomerisierung Substrat L-Methylmalonyl-CoA Produkte Succinyl-CoA Methylmalonyl-CoA-Mutase (MCM) ist ein Enzym, das im Stoffwechsel aller Lebewesen zum Abbau mehrerer Aminosäuren, Fettsäuren und Cholesterin benötigt wird. MCM katalysiert den Reaktionsschritt von L-Methylmalonyl-CoA zu Succinyl-CoA, eine Umlagerung; daher gehört MCM zu den Isomerasen. In manchen Bakterien ist es Teil des Aufbaus von Propionat aus Citratzyklus-Zwischenprodukten. Bei Eukaryoten ist MCM in den Mitochondrien lokalisiert. Mangel an MCM führt beim Menschen zur erblichen und oft tödlichen Methylmalonazidämie.[1]
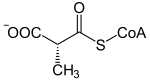
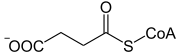
Katalysierte Reaktion
L-Methylmalonyl-CoA wird zu Succinyl-CoA umgelagert. In Bakterien läuft die Reaktion in Gegenrichtung ab.
Einzelnachweise
Weblinks
 Wikibooks: Biochemie und Pathobiochemie: Abbau von Propionyl-CoA – Lern- und Lehrmaterialien
Wikibooks: Biochemie und Pathobiochemie: Abbau von Propionyl-CoA – Lern- und Lehrmaterialien
Wikimedia Foundation.