- 1,2-Cyclohexandiamin
-
Strukturformel 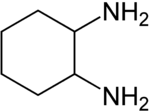
Allgemeines Name 1,2-Diaminocyclohexan Andere Namen - 1,2-Cyclohexandiamin
- DACH
Summenformel C6H14N2 CAS-Nummer - 694-83-7 (Isomerengemisch)
- 1121-22-8 (trans-Isomerengemisch)
- 1436-59-5 (cis-Isomerengemisch)
- 20439-47-8 ((1R,2R)-(−)-Enantiomer)
- 21436-03-3 ((1S,2S)-(+)-Enantiomer)
Kurzbeschreibung farblose Flüssigkeit mit aminartigem Geruch[1] Eigenschaften Molare Masse 114,19 g·mol-1 Aggregatzustand flüssig
Dichte 0,95 g/cm3[1]
Siedepunkt Dampfdruck Löslichkeit löslich in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34-43 S: 26-36/37/39-45 WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,2-Diaminocyclohexan ist eine chemische Verbindung. Sie besteht aus einem Cyclohexanring als Grundgerüst, an dem zwei Aminogruppen an benachbarten Kohlenstoffatomen gebunden sind und gehört somit zur Gruppe der Diamine.
Inhaltsverzeichnis
Darstellung
1,2-Diaminocyclohexan kann durch einen Curtius-Abbau von 1,2-Cyclohexandicarbonsäure hergestellt werden.[2] Wird die trans-Disäure verwendet, sind die Aminogruppen am Produkt ebenfalls trans-ständig. Analoges gilt für die Verwendung der cis-Disäure. Die Auftrennung des racemisch erhaltenen Produkts in seine Enantiomere lässt sich durch die Behandlung mit enantiomerenreiner Weinsäure bewerkstelligen.[3]
Eigenschaften
Es handelt sich um eine farblose bei Raumtemperatur flüssige Verbindung, die bei 183 °C siedet. Der Drehwert der reinen Substanz bei 55 °C und einer Wellenlänge von 589 nm beträgt −36° (R,R-Enantiomer).[3]
Verwendung
Durch Kondensationsreaktionen mit α,β-Diketonen kann 1,2-Diaminocyclohexan zur Synthese von Pyrazinen benutzt werden. Unter Abspaltung von zwei Wassermolekülen werden so zunächst Diimine erhalten, die dann zu Pyrazinen oxidiert werden können.
Durch Kondensation mit aktivierten Carbonsäuren (Steglich-Veresterung) oder Carbonsäurechloriden können Amide hergestellt werden. Diese Reaktion wird beispielsweise zur Synthese des Trost-Liganden eingesetzt.[4]
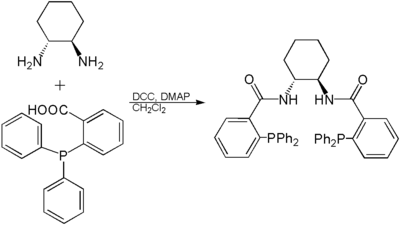 Synthese des Trost-Liganden aus 2-Diphenylphosphinocarbonsäure, trans-1,2-Diaminocyclohexan, Dicyclohexylcarbodiimid und 4-Dimethylaminopyridin in Dichlormethan.
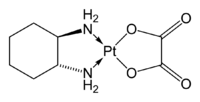
Synthese des Trost-Liganden aus 2-Diphenylphosphinocarbonsäure, trans-1,2-Diaminocyclohexan, Dicyclohexylcarbodiimid und 4-Dimethylaminopyridin in Dichlormethan.Des Weiteren kann 1,2-Diaminocyclohexan als Diaminoligand in Metallkomplexen eingesetzt werden. Hier tritt es als zweizähniger Chelatligand auf. So sind beispielsweise Oxaliplatinverbindungen, die als Zytostatika eingesetzt werden, Platinkomplexe des 1,2-Diaminocyclohexans.
Quellen
- ↑ a b c d e f g Sicherheitsdatenblatt Merck
- ↑ Wieland, Schlichting, v. Langsdorff, Hoppe-Seyler’s Z. Physiol. Chem. 1926, 161, 76. ISSN 0018-4888
- ↑ a b F. M. Jaeger, L. Bijkerk: Uber komplexe Salze des dreiwertigen Kobalts, Chroms und Rhodiums mit razemischen und optisch-aktiven trans-Cyclohexan-l,2-Diaminen, in: Z. Anorg. Allg. Chem. 1937, 233, 97–139. ISSN 0044-2313, doi:10.1002/zaac.19372330202
- ↑ Doktorarbeit B. J. Lüssem RWTH Aachen.
Wikimedia Foundation.