- Jacobsen-Epoxidierung
-
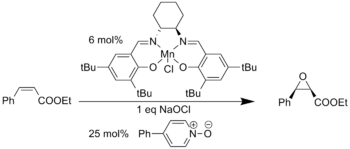
Die Jacobsen-Epoxidierung (Jacobsen-Katsuki-Epoxidierung) ist eine von Eric N. Jacobsen gefundene enantioselektive Alken-Epoxidierung und gehört zur Gruppe der katalytisch asymmetrischen Reaktionen. Im Gegensatz zur Sharpless-Epoxidierung ist sie nicht auf Allylalkohole beschränkt, sondern allgemein bei mehrfach substituierten, nicht aktivierten Alkenen anwendbar [1]. Dafür werden Alkene mit Oxidationsmitteln wie Natriumhypochlorit-"Bleichlauge" unter Katalyse durch chirale Mangan(III)-Salenkomplexe umgesetzt; als Vorbild in der Natur diente Cytochrom P450.
Inhaltsverzeichnis
Reaktionsbedingungen
Die Jacobsen-Epoxidierung wird typischerweise in Dichlormethan oder Acetonitril bei Raumtemperatur durchgeführt, mit Natriumhypochlorit oder meta-Chlorperbenzoesäure (mCPBA) als Oxidationsmittel, und Zusätzen von N-Oxiden. Als Substrate können disubstituierte oder auch trisubstituierte Alkene[2] verwendet werden. Als Präkatalysator wird ein (Salen)Mn(III)Cl-Komplex zugesetzt.
Mechanismus
Der Katalysator wird zunächst durch das Oxidationsmittel in die (Salen)Mn(V)O-Form überführt. Die weiteren mechanistischen Details sind noch umstritten. Als wahrscheinlich wird folgender Verlauf angesehen[3]: Die gebildete reaktive (Salen)Mn(V)O-Form setzt sich mit dem Alken zu einer radikalischen Mn(IV)-Spezies mit einer Mn-O-Bindung um, welche unter Bildung der zweiten C-O-Einfachbindung zum Mn(III)-Oxiran-Komplex reagiert.
Die chirale Information liegt bei dieser Reaktion im Cyclohexandiamin-Rückgrat des Salen-Liganden. Zu beachten sind die tert-Butyl-Gruppen an den Salicylaldehyduntereinheiten: Ohne diese Gruppen würden Phenole durch Oxidationsmittel wie NaOCl zu Chinonen oxidiert, die tBu-Gruppen verhindern jedoch diese Oxidation und damit die Zerstörung des Liganden unter den Reaktionsbedingungen.
Einzelnachweise
- ↑ Christoph Elschenbroich: Organometallchemie, 5. Auflage, Wiesbaden 2005, S. 622.
- ↑ Bridget D. Brandes, Eric N. Jacobsen: Highly Enantioselective, Catalytic Epoxidation of Trisubstituted Olefins. In: The Journal of Organic Chemistry. 59, Nr. 16, 1994, S. 4378–4380, doi:10.1021/jo00095a009.
- ↑ Christian Linde, Bjorn Akermark, Per-Ola Norrby, Mats Svensson: Timing Is Critical: Effect of Spin Changes on the Diastereoselectivity in Mn(salen)-Catalyzed Epoxidation. In: Journal of the American Chemical Society. 121, Nr. 21, 1. Mai 1999, S. 5083–5084, doi:10.1021/ja9809915.
Literatur
- Eric N. Jacobsen, Wei Zhang, Alexander R. Muci, James R. Ecker, Li Deng: Highly enantioselective epoxidation catalysts derived from 1,2-diaminocyclohexane. In: Journal of the American Chemical Society. 113, Nr. 18, 1991, S. 7063–7064, doi:10.1021/ja00018a068.
- Tsutomu Katsuki: Catalytic asymmetric oxidations using optically active (Salen)manganese(III) complexes as catalysts. In: Coordination Chemistry Reviews. 140, Februar 1995, S. 189–214, doi:10.1016/0010-8545(94)01124-T.
Wikimedia Foundation.