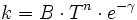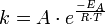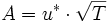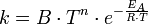Arrhenius-Faktor — Die Arrhenius Gleichung (nach Svante Arrhenius) beschreibt in der chemischen Kinetik die quantitative Abhängigkeit der Reaktionsgeschwindigkeitskonstante k von der Temperatur. A: präexponentieller Faktor oder Frequenzfaktor, entspricht nach der… … Deutsch Wikipedia
Arrhenius-Gleichung — Die Arrhenius Gleichung, benannt nach Svante Arrhenius, beschreibt in der chemischen Kinetik die quantitative Abhängigkeit der Reaktionsgeschwindigkeitskonstante k von der Temperatur. A: präexponentieller Faktor oder Frequenzfaktor, entspricht… … Deutsch Wikipedia
Chemienobelpreis 1903: Svante August Arrhenius — Der schwedische Wissenschaftler erhielt den Nobelpreis für »das außerordentliche Verdienst, das er sich durch seine Theorie über die elektrolytische Dissoziation erworben hat«. Biografie Svante August Arrhenius, * Uppsala, 19.2.1859, ✝… … Universal-Lexikon
Kennzahlen der Physik — Als dimensionslose Kennzahl (der Physik) bezeichnet man einen Parameter in einem dimensionslosen mathematischen Modell eines physikalischen Zustands oder Prozesses. Wenn zwei Zustände oder Prozesse durch dasselbe mathematische Modell definiert… … Deutsch Wikipedia
Arrheniusgleichung — Die Arrhenius Gleichung (nach Svante Arrhenius) beschreibt in der chemischen Kinetik die quantitative Abhängigkeit der Reaktionsgeschwindigkeitskonstante k von der Temperatur. A: präexponentieller Faktor oder Frequenzfaktor, entspricht nach der… … Deutsch Wikipedia
Dimensionslose Kennzahl — Als dimensionslose Kennzahl (der Physik), Ähnlichkeitskennzahl oder auch als Kenngröße bezeichnet man einen Parameter in einem dimensionslosen mathematischen Modell eines physikalischen Zustands oder Prozesses. Wenn zwei Zustände oder Prozesse… … Deutsch Wikipedia
Erderwärmung — Komponenten des Strahlungsantriebs mit der resultierenden Erwärmung der letzten 100 Jahre … Deutsch Wikipedia
GlobaleErwärmung — Komponenten des Strahlungsantriebs mit der resultierenden Erwärmung der letzten 100 Jahre … Deutsch Wikipedia
Globale Erderwärmung — Komponenten des Strahlungsantriebs mit der resultierenden Erwärmung der letzten 100 Jahre … Deutsch Wikipedia
Globaler Klimawandel — Komponenten des Strahlungsantriebs mit der resultierenden Erwärmung der letzten 100 Jahre … Deutsch Wikipedia
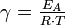 zusammengefasst:
zusammengefasst: