- Aktivierungsenergie
-
Die Aktivierungsenergie (geprägt 1889 von Svante Arrhenius) ist für einen physikalischen oder chemischen Prozess erforderlich, wenn in seinem Verlauf eine Barriere überwunden werden muss.
Inhaltsverzeichnis
Reaktionskinetik
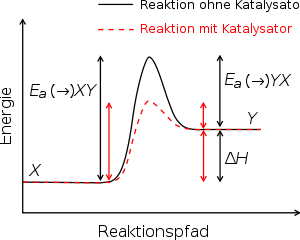 Die Beziehung zwischen Aktivierungsenergie (Ea) und Bildungsenthalpie (ΔH) mit und ohne Katalysator am Beispiel einer endothermen Reaktion. Die energetisch höchste Position repräsentiert den Übergangszustand. Durch einen Katalysator wird die benötigte Energie um den Übergangszustand zu erreichen verringert, womit auch die für die Reaktion benötigte Energie kleiner wird.
Die Beziehung zwischen Aktivierungsenergie (Ea) und Bildungsenthalpie (ΔH) mit und ohne Katalysator am Beispiel einer endothermen Reaktion. Die energetisch höchste Position repräsentiert den Übergangszustand. Durch einen Katalysator wird die benötigte Energie um den Übergangszustand zu erreichen verringert, womit auch die für die Reaktion benötigte Energie kleiner wird.
Die physikalische Chemie versteht unter der Aktivierungsenergie die Energiebarriere, die von einem Reaktionskomplex überwunden werden muss, damit eine Reaktion ablaufen kann. Beim Zusammentreffen der Reaktionspartner verbinden sich diese vorübergehend zum aktivierten Komplex (der Bereich des Maximums in der Graphik auf der rechten Seite). Je höher die Temperatur des Reaktionssystems, umso höher ist die Wahrscheinlichkeit, dass die Reaktanden die benötigte Aktivierungsenergie bereitstellen und zum Produkt weiterreagieren können.
Der Zusammenhang zwischen Aktivierungsenergie und Temperatur wird quantitativ durch die Arrhenius-Gleichung beschrieben:
Was die Aktivierungsenergie nicht ist
Bestimmte vereinfachende, aber falsche Annahmen werden gerne wiederholt. Entgegen diesen Annahmen ist die Aktivierungsenergie
- nicht die Energie, die (von außen) einer endothermen Reaktion zugeführt werden muss
- kein unmittelbares Maß für die absolute Reaktionsgeschwindigkeit
- nicht identisch mit der "Schwellenenergie" der klassischen Stoßtheorie
Tatsächlich beschreibt das Modell von Arrhenius die Vorgänge bei einer chemischen Reaktion nur unvollständig; der Faktor A ist eine rein empirische Größe, die ihrerseits wieder von der Temperatur abhängt. Für einige Reaktionen wurde eine negative Aktivierungsenergie gefunden, was für eine einfache Reaktion physikalisch unmöglich scheint. Tatsächlich hängen beobachtete negative Aktivierungsenergien damit zusammen, dass dem geschwindigkeitsbestimmenden Reaktionsschritt andere Reaktionen vorgelagert sind. Nach Eyring (siehe auch Theorie des Übergangszustandes) ist die Freie Aktivierungsenthalpie
 die bestimmende Größe für die Reaktionsgeschwindigkeit.
die bestimmende Größe für die Reaktionsgeschwindigkeit.Katalyse
Ein (positiver) Katalysator setzt die Aktivierungsenergie für chemische Reaktionen herab, ändert jedoch nicht die freie Reaktionsenthalpie ΔRG. Man nimmt an, dass bei Anwesenheit eines Katalysators ein Komplex mit niedrigerer Aktivierungsenergie gebildet wird und so die Reaktionswahrscheinlichkeit steigt.
Halbleiter
- Für einen undotierten Halbleiter ist es die Energie, die notwendig ist, um ein Elektron bzw. ein Loch als freien Ladungsträger zu gewinnen. Dies ist identisch mit dem Bandabstand zwischen Valenzband und Leitungsband, der als Bandlücke bezeichnet wird. Dadurch werden in den Atomen zuvor fest gebundene Elektronen (Valenzband) in einen Zustand angehoben, in dem sie sich frei bewegen können (Leitungsband). Die Elektronen können damit zum Stromtransport im Halbleiter beitragen, gelten also als aktiviert. Die Aktivierungsenergie kann entweder mittels thermischer Energie oder Stößen mit Teilchen (z. B. Photonen) zugeführt werden.
- Für einen dotierten Halbleiter ist die Energie, um einen freien Ladungsträger zu erzeugen, weitaus geringer. Die Dotieratome bilden Energieniveaus in der Bandlücke. Die Aktivierungsenergie ist damit der Unterschied zwischen diesen Energieniveaus und dem nächstgelegenen Band. Für p-dotierte Halbleiter ist es damit der Unterschied zwischen Dotierniveau und Valenzband, für n-Halbleiter der Unterschied zwischen Dotierniveau und Leitungsband.
Siehe auch
Literatur
Weblinks
Wikimedia Foundation.

