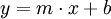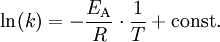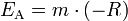- Arrhenius-Plot
-
Als Arrheniusgraphen (auch Arrheniusdarstellung oder Arrheniusplot) bezeichnet man eine graphische Darstellung, bei der die Werte einer Messgröße (z. B. die Geschwindigkeitskonstante einer chemischen Reaktion) logarithmisch gegen den Kehrwert der Temperatur aufgetragen werden. Dadurch werden exponentiell von der Temperatur abhängige Werte auf eine Gerade abgebildet. Man spricht in diesem Zusammenhang allgemein auch von der Linearisierung einer Funktion.
Inhaltsverzeichnis
Anwendung
Formelsymbole EA Aktivierungsenergie J mol−1 kB Boltzmann-Konstante 1,381·10−23 J·K−1 R universelle Gaskonstante 8,314 J mol−1·K−1 NA Avogadro-Konstante 6,022·1023·mol−1 T absolute Temperatur K Verwendet wird diese Art der Auftragung bei chemischen oder physikalischen Vorgängen, deren mathematische Beschreibung die Boltzmann-Konstante in der Form
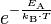 (einzelne Teilchen, siehe Boltzmann-Faktor)
(einzelne Teilchen, siehe Boltzmann-Faktor)
oder
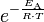 (makroskopische Ebene)
(makroskopische Ebene)
als Term enthält.
In dieser Darstellung erscheint die Abhängigkeit der Messgröße von der Temperatur als Gerade, deren Steigung umgekehrt proportional zur Aktivierungsenergie EA ist. Bezogen auf die Geradengleichung
entspricht die Steigung m dem Ausdruck
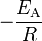 und der Kehrwert der Temperatur
und der Kehrwert der Temperatur 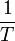 dem x-Wert.
dem x-Wert.Beispiele
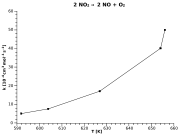
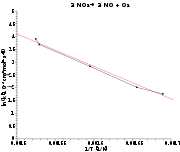
Zerfall Stickstoffdioxid 2 NO2 → 2 NO + O2 Naturgesetze, die im Arrheniusplot linear dargestellt werden, sind die Temperaturabhängigkeit der Reaktionsgeschwindigkeit (Arrhenius-Gleichung) und des Diffusionskoeffizienten in festen Stoffen. Nimmt man den natürlichen Logarithmus der Arrheniusgleichung:
kann die Aktivierungsenergie nach
aus der Geradensteigung errechnet werden.
Auch wenn aufgrund von experimentellen Beobachtungen eine entsprechende Gesetzmäßigkeit vermutet wird, kann diese Annahme mit Hilfe der Arrheniusdarstellung beurteilt werden.
Siehe auch
Quellen
Wikimedia Foundation.