- Opine
-
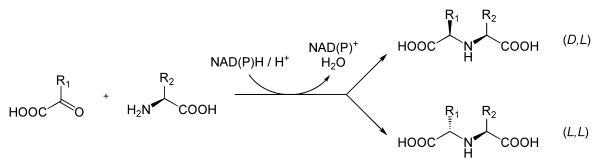
Opine (N-Carboxyethyl-Aminosäuren) sind stickstoffreiche organische Verbindungen, die durch Kondensation von α-Ketosäuren und Aminosäuren entstehen.
Inhaltsverzeichnis
Synthese
Opine sind Endprodukte des anaeroben Abbaus und entstehen durch Bindung von Pyruvat an eine Aminosäure.[1]
Eigenschaften
Opine kommen in der Natur hauptsächlich in marinen Invertebraten vor, aber auch in genetisch veränderten Pflanzenzellen.[2] Die Transfektion der pflanzlichen Zellen wird durch Bakterien der Gattung Agrobacterium ausgelöst, das heißt, die Bakterien übertragen die Gene für die Opinsynthese in die Pflanzenzelle. Pflanzen ist es nicht möglich, Opine zu verwerten – den in den Pflanzen lebenden Bakterien dienen sie jedoch als Kohlenstoff-, Stickstoff- und Energiequelle. Dabei induziert und verwertet jeder Agrobacterium-Stamm seine eigenen Opine. Die Gene für die Opinsynthese befinden sich auf einem speziellen Plasmid, dem sogenannten Ti-Plasmid. Bisher wurden mehr als 30 verschiedene Opine beschrieben. Das erste davon wurde bereits 1927 von Morizawa aus dem Cephalopoden Octopus octopodia isoliert und folglich Octopin genannt. Die erste Opindehydrogenase wurde 1969 aus dem Adduktormuskel der Pilgermuschel, Pecten maximus isoliert.[3]
Zu den Opinen gehören beispielsweise
- Alanopin
- Strombin
- Opalin
- Nopalin
- Agropin
- Mannopin
- Octopin
Die wichtigsten Opine sind jedoch Octopin und Nopalin, Kondensate von Arginin mit Pyruvat bzw. α-Ketoglutarat.
Octopin findet sich in gentechnisch veränderten Zellen und in den Muskelzellen bestimmter Molluskenarten, unter anderem beim Octopus, wieder. Daher stammt auch der Name Octopin. Nopal ist der französische Name für den Kaktus Opuntia vulgaris. In Tumoren dieser Kakteenart wurde zuerst die Verbindung Nopalin gefunden.
Siehe auch
Einzelnachweise
- ↑ Gerhard Heldmaier,Gerhard Neuweiler; Vergleichende Tierphysiologie. Bd.2: Vegetative Physiologie; S.49; ISBN 978-3540000679
- ↑ a b Ulrike Hergert; Erkenntnisse zur Evolution von Invertebraten-Opindehydrogenasen; ISBN 978-3867274883
- ↑ Vergleichende thermodynamische Analyse der Substratbindung an die rekombinante Oktopindehydrogenase aus der Pilgermuschel, Pecten maximus, und an die Laktatdehydrogenase aus dem Schweinemuskel
Wikimedia Foundation.