- Alanin
-
Strukturformel 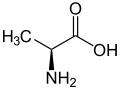
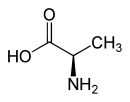
L-Alanin (links) bzw. D-Alanin (rechts) Allgemeines Name Alanin Andere Namen - L-(+)-Alanin
- α-Alanin
- L-α-Aminopropionsäure
- (S)-Alanin
- (S)-2-Aminopropansäure
- D-(−)-Alanin
- Abkürzungen:
- Ala (Dreibuchstabencode)
- A (Einbuchstabencode)
Summenformel C3H7NO2 CAS-Nummer - 56-41-7 (L-Enantiomer)
- 338-69-2 (D-Enantiomer)
PubChem 5950 ATC-Code V06[1]
DrugBank NUTR00013 Kurzbeschreibung farbloser bis gelblicher Feststoff[1]
Eigenschaften Molare Masse 89,10 g·mol−1 Aggregatzustand fest
Dichte 1,42 g·cm−3[2]
Schmelzpunkt pKs-Wert Löslichkeit - gut löslich in Wasser
(166,5 g·kg−1 bei 25 °C;
217,9 g·kg−1 bei 50 °C;
285,1 g·kg−1 bei 75 °C;
373,0 g·kg−1 bei 100 °C)[4] - schlecht löslich in Ethanol[1]
- unlöslich in Diethylether[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Alanin, abgekürzt Ala oder A, ist eine α-Aminosäure, die in Form des α-Alanins chiral ist, also in zwei spiegelbildlichen Formen auftritt, wobei das L-Alanin eine proteinogene Aminosäure ist, die nach IUPAC auch als (S)-2-Aminopropansäure oder als (S)-Alanin bezeichnet wird. D-Alanin [Synonym: (R)-Alanin] findet man als Baustein des Mureins, der Grundsubstanz von Bakterienzellwänden. Daneben gibt es noch das nichtproteinogene β-Alanin.
Inhaltsverzeichnis
Synthese
Die industrielle Herstellung[5] von L-Alanin erfolgt ausgehend von der L-Asparaginsäure durch Abspaltung der β-Carboxygruppe in einem biotechnologischen Verfahren. Durch Strecker-Synthese gewonnenes racemisches Alanin kann an der Aminogruppe acetyliert werden und wird dann einer Racematspaltung [6] unterworfen. Dabei wird unter Verwendung von L-Aminoacylase [7] enantioselektiv die Acetylgruppe von L-N-Acetylalanin abgespalten und es entsteht L-Alanin, während D-N-Acetylalanin nicht hydrolysiert wird. Die Trennung von L-Alanin und D-N-Acetylalanin ist einfach. Benötigt man D-Alanin, so wird D-N-Acetylalanin unter sauren Bedingungen hydrolysiert, d. h. die Acetylgruppe wird abgespalten. Wenn kein Bedarf für D-Alanin besteht, wird das bei der kinetischen Racematspaltung anfallende D-N-Acetylalanin durch Einwirkung von Essigsäureanhydrid racemisiert und recycliert.
DL-Alanin kann auch aus 2-Brompropansäure synthetisiert werden, dieses Verfahren besitzt jedoch keine industrielle Bedeutung.
Im Stoffwechsel wird L-Alanin durch Transaminierung aus dem Endprodukt der Glykolyse, dem Pyruvat, synthetisiert. Bakterien erhalten benötigtes D-Alanin aus L-Alanin mittels des Enzyms Alaninracemase (EC 5.1.1.1).[8]
Eigenschaften
Alanin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Alanin auch seine geringste Löslichkeit in Wasser hat.
Physiologische Funktionen
In Umkehrung dieser Synthese-Reaktion kann es enzymatisch auch wieder zu Pyruvat abgebaut werden (Transdesaminierung). So kann das Kohlenstoffgrundgerüst über Pyruvat wieder zum Aufbau von Glukose (Glukoneogenese) verwendet oder über den Zitronensäurezyklus vollständig zur Energiegewinnung abgebaut werden. Die oxidative Desaminierung des L-Alanins zu Pyruvat und Ammoniak, katalysiert durch das Enzym Alanin-Dehydrogenase, stellt eine weitere Abbaumöglichkeit dar; sie macht beispielhaft deutlich, wie ein Teil des Aminosäurestoffwechsels mit dem Kohlenhydratstoffwechsel verknüpft ist.
Beim physiologischen pH-Wert von 7,4 liegt die Carboxygruppe deprotoniert und die Aminogruppe protoniert als –NH3+ vor.
Alanin tritt – neben anderen Aminosäuren wie z. B. Leucin und Glutaminsäure – in α-Helices von Proteinen bevorzugt auf. Diese Aminosäuren begünstigen die Bildung dieses Sekundärstrukturelements und werden deshalb auch als Helixbildner bezeichnet.[9]
Verwendung
Bestandteil von Infusionslösungen zur parenteralen Ernährung und von Diätetika.[10]
Edukt in chemischen Synthesen
Die beiden Enantiomeren des Alanins werden, mit einer Schutzgruppe versehen, häufig für die Synthese von Peptiden und Proteinen eingesetzt[11][12]. Weiterhin werden L- oder D-Alanin auch in der stereoselektiven Synthese als Edukt eingesetzt[13][14][15].
Siehe auch
Einzelnachweise
- ↑ a b c d Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c Eintrag zu Alanin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. November 2007 (JavaScript erforderlich).
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 822.
- ↑ CRC Handbook of Chemistry and Physics, 1. Student Edition, Herausgeber: Robert C. Weast, S. C-706, CRC Press, Boca Raton, Florida, 1988, ISBN 0-8493-0740-6.
- ↑ Yoshiharu Izumi, Ichiro Chibata, Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1987) S. 187–194; Angewandte Chemie International Edition in English, 17 (1978), S. 176–183.
- ↑ Hans-Ulrich Blaser, Elke Schmidt: Asymmetric Catalysis on Industrial Scale, 1. Auflage, 2003, ISBN 3-527-30631-5, dort Aufsatz von Harald Gröger und Karlheinz Drauz auf S. 131–145.
- ↑ W. Hartmeier: Immobilisierte Biokatalysatoren — auf dem Weg zur zweiten Generation, Naturwissenschaften 72 (1985) S. 310–314 und dort zitierte Literatur.
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2.
- ↑ Berg, Tymozcko, Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg, Berlin 2003, ISBN 978-3-8274-1303-1.
- ↑ S. Ebel und H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 17, ISBN 3-13-672201-9.
- ↑ Jesse Philip Greenstein, Milton Winitz: Chemistry of Amino Acids. Band 1 bis 3, John Wiley & Sons, 1962, ISBN 0-471-32637-2
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2.
- ↑ Karlheinz Drauz, Axel Kleemann, Jürgen Martens: Induktion von Asymmetrie durch Aminosäuren. In: Angewandte Chemie. 94, Nr. 8, 1982, S. 590-613, doi:10.1002/ange.19820940804.
- ↑ J. Martens: Asymmetric syntheses with amino acids. In: Topics in current chemistry. 125, Springer, Berlin 1984, ISBN 978-3-540-13569-2, S. 165-246, doi:10.1007/3-540-13569-3_5.
- ↑ Gary M. Coppola, Garry M. Coppola: Asymmetric Synthesis: Construction of Chiral Molecules Using Amino Acids. 2. Auflage. John Wiley & Sons, 1987, ISBN 0471828742.
Weblinks
Sicherheitsdatenblätter
- Datenblatt Alanin bei Acros, abgerufen am 24. Februar 2010.
- Datenblatt Alanin bei AlfaAesar, abgerufen am 24. Februar 2010 (JavaScript erforderlich).
- Datenblatt Alanin bei Carl Roth, abgerufen am 24. Februar 2010.
- Datenblatt Alanin bei Merck, abgerufen am 24. Februar 2010.
- Datenblatt Alanin bei Merck, abgerufen am 19. Januar 2011.
 Proteinogene Aminosäuren
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Hydroxylysin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.

