- PEPCK
-
Phosphoenolpyruvat-Carboxykinase, zytosolisch Bänder-/Oberflächenmodell der PEPCK-C nach PDB 1KHF. Gebundenes PEP ist als Kalotte hervorgehoben. Vorhandene Strukturdaten: s. UniProt Größe 622 Aminosäuren Kofaktor Mangan Bezeichner Gen-Name PCK1 Externe IDs OMIM: 261680 UniProt: P35558 Enzymklassifikation EC, Kategorie 4.1.1.32 Lyase Reaktionsart Phosphorylierende Decarboxylierung Substrat GTP + Oxalacetat Produkte GDP + Phosphoenolpyruvat + CO2 Vorkommen Homologie-Familie PEPCK (GTP) Übergeordnetes Taxon Lebewesen Ausnahmen Pflanzen Phosphoenolpyruvat-Carboxykinase, mitochondrial —
Größe 608 Aminosäuren Kofaktor Mangan Bezeichner Gen-Name PCK2 Externe IDs OMIM: 261650 UniProt: Q16822 Phosphoenolpyruvat-Carboxykinase [GTP] (Abk.: PEPCK) heißt dasjenige Enzym, das die Umwandlung von Oxalacetat mittels GTP zu Phosphoenolpyruvat katalysiert. Dieser Reaktionsschritt ist der geschwindigkeitsbestimmende Teilschritt der Gluconeogenese. PEPCK kommt auch in Bakterien vor, in Wirbeltieren gibt es zwei Isoformen, zytosolisch und mitochondrial. Sie werden im Menschen von den Genen PCK1 und PCK2 codiert und besonders in Leber, Nieren und Adipozyten exprimiert. Im Gegensatz zu PEPCK-M kann die Aktivität der PEPCK-C durch Hormone reguliert werden. Mutationen in PCK1 oder PCK2 können die entsprechende (seltene) PEPCK-Mangelkrankheit verursachen.[1]
Die PEPCK [GTP] ist nicht zu verwechseln mit der ATP-abhängigen PEPCK, die in Pflanzen und Bakterien, aber nicht in Tieren vorkommt.
Aufgrund ihrer zentralen Position in der Gluconeogenese ist die PEPCK ein Kandidat, wenn es um erblichen Diabetes oder Fettleibigkeit geht. [2]
Inhaltsverzeichnis
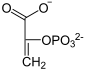
Katalysierte Reaktion
Von GTP wird eine Phosphatgruppe auf Oxalacetat übertragen und Kohlenstoffdioxid abgespalten.
Regulation
Die Aktivität der PEPCK-C, und damit die Gluconeogenese insgesamt, wird von einer Reihe von Hormonen beeinflusst. Glucagon fördert in der Leber durch die Phosphorylierung eines Transkriptionsfaktors die Transkription der PEPCK, genauso wie all-trans Retinsäure. Weitere regulierende Moleküle sind Leber-Lipide, Insulin (via SREBP-1c) und γ-Interferon.[3][4][5][6][7]
Für die Regulation durch Glucocorticoide siehe das ausführliche Beispiel dort.
Einzelnachweise
- ↑ UniProt P35558, UniProt Q16822
- ↑ Beale EG, Harvey BJ, Forest C: PCK1 and PCK2 as candidate diabetes and obesity genes. In: Cell Biochem. Biophys.. 48, Nr. 2-3, 2007, S. 89–95. PMID 17709878
- ↑ Christ B: Inhibition of glucagon-signaling and downstream actions by interleukin 1beta and tumor necrosis factor alpha in cultured primary rat hepatocytes. In: Horm. Metab. Res.. 40, Nr. 1, January 2008, S. 18–23. PMID 18335579
- ↑ Cadoudal T, Glorian M, Massias A, Fouque F, Forest C, Benelli C: Retinoids upregulate phosphoenolpyruvate carboxykinase and glyceroneogenesis in human and rodent adipocytes. In: J. Nutr.. 138, Nr. 6, June 2008, S. 1004–9. PMID 18492826
- ↑ Chen G: Liver lipid molecules induce PEPCK-C gene transcription and attenuate insulin action. In: Biochem. Biophys. Res. Commun.. 361, Nr. 3, September 2007, S. 805–10. doi:10.1016/j.bbrc.2007.07.108. PMID 17678617
- ↑ Chakravarty K, Hanson RW: Insulin regulation of phosphoenolpyruvate carboxykinase-c gene transcription: the role of sterol regulatory element-binding protein 1c. In: Nutr. Rev.. 65, Nr. 6 Pt 2, June 2007, S. S47–56. PMID 17605314
- ↑ Khazen W, Distel E, Collinet M, et al: Acute and selective inhibition of adipocyte glyceroneogenesis and cytosolic phosphoenolpyruvate carboxykinase by interferon gamma. In: Endocrinology. 148, Nr. 8, August 2007, S. 4007–14. doi:10.1210/en.2006-1760. PMID 17495004
Weblinks
Wikimedia Foundation.