- Standardtemperatur
-
Unter Standardbedingungen versteht man vereinbarte Werte bestimmter Größen, in der Regel von physikalischen und chemischen Größen. Oft sind mit der Bezeichnung „Standardbedingungen“ die sogenannten Normalbedingungen gemeint, die jedoch vom Begriff Standardbedingungen zu unterscheiden sind. Dadurch kommt es leicht zu Missverständnissen. Zweck der Vereinbarung und Festlegung von Standardbedingungen ist eine Einheitlichkeit von Bedingungen, ohne die Vergleiche, z. B. von Untersuchungsergebnissen, nicht möglich wären. Standardbedingungen sind daher von Bedeutung für Forschung, Wissenschaft und Praxis. Folgende Bedingungen werden in verschiedenen Disziplinen als Standardbedingungen bezeichnet.
Physikalische Standardbedingungen
In der Praxis sind die Standardbedingungen (NTP, vom englischen Begriff „Normal Temperature and Pressure“) im Gegensatz zu den Normalbedingungen nicht weltweit einheitlich definiert.
Für Europa werden historisch die Bedingungen aus Amsterdam herangezogen:
- Standarddruck p = 1 atm = 101325 Pa = 1013,25 hPa = 101,325 kPa = 1,01325 bar
- Standardtemperatur T = 298,15 K ⇔ 25 °C und dabei ist die Luftdichte
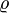 = 1,184 kg/m3.
= 1,184 kg/m3.
- Weiterhin ist üblich T = 293,15 K ⇔ 20 °C und dabei ist die Luftdichte
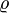 = 1,204 kg/m3.
= 1,204 kg/m3.
Chemische Standardbedingungen
In der Chemie, insbesondere in der physikalischen Chemie und der chemischen Thermodynamik, versteht man unter den Standardbedingungen oft einen Druck von 1 bar oder 100 kPa.
In der physikalischen Chemie bezieht man die Standardbedingungen oft auch bei mehreren gasförmigen Stoffen auf einen Partialdruck von jeweils 1 bar.
In der Elektrochemie bezieht man sich bei der Angabe des Standard-Redoxpotentials auf die Standardbedingung, dass alle beteiligten Stoffe eine Aktivität von 1 besitzen. Bei sehr verdünnten Lösungen ist die Aktivität ungefähr gleich der Konzentration; in diesem Fall ist der Standardzustand eines Stoffes in Lösung gleich 1 mol/L.
Bei der Angabe von Potentialen in saurer Lösung setzt man die Konzentration der H3O+-Ionen auf 1 mol/L fest, in basischen Lösungen die Konzentrion der OH--Ionen. Dementsprechend korrespondieren die Standardbedingungen in der Elektrochemie zu einem pH-Wert von 0 oder 14.
Im Gegensatz dazu werden in der Biochemie oft Angaben gemacht, die sich auf die Standardbedingung "pH 7" beziehen.
Siehe auch
- Gibbs-Energie (Freie Enthalpie)
- Gruppenübertragungspotential
- Standard-Testbedingungen in der Photovoltaik
Wikimedia Foundation.
