- Streckersynthese
-
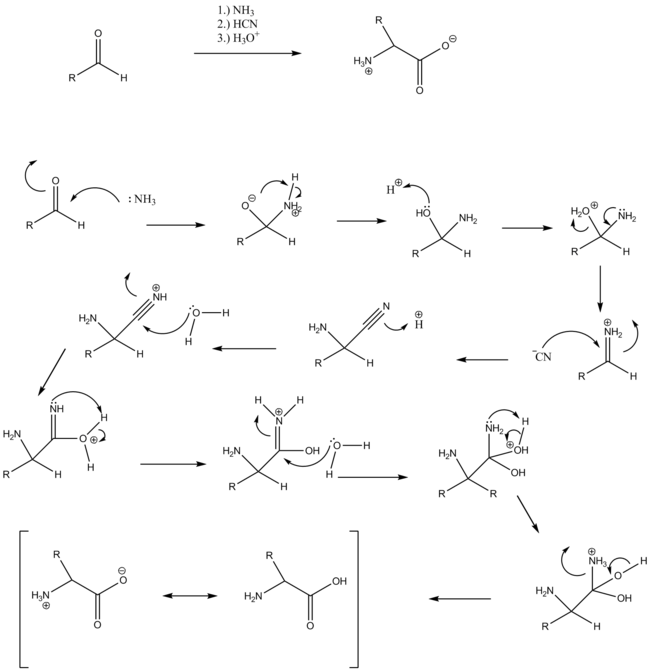
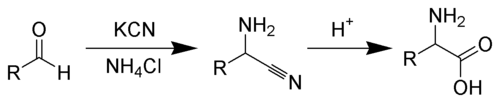
Die Strecker-Synthese ist eine Namensreaktion der Organischen Chemie. Ihr Entdecker, Adolph Strecker (*1822, †1871), publizierte sie erstmals 1850[1]. Es handelt sich um einen Spezialfall der Mannich-Reaktion, bei dem aus Aldehyden, Ammoniak und Cyanwasserstoff (HCN) α-Aminocarbonsäuren bzw. Aminosäuren entstehen. Die Synthese ist ferner gültig für primäre und sekundäre Amine.
Inhaltsverzeichnis
Mechanismus
Die Reaktion verläuft über die nucleophile Addition des Ammoniak an den Aldehyden, diese verläuft im Allgemeinen bis zum Imin. An diese ebenfalls elektrophile Spezies addiert sich das Cyanid, es entsteht so ein α-Aminonitril, welches sich im Sauren zur α-Aminosäure hydrolysieren lässt.
Praxis
Nachteil der Streckersynthese ist vor allem, dass aufgrund der fehlenden asymmetrischen Induktion die Aminosäuren racemisch entstehen. Dies erhöht aufgrund der per se um 50 % verringerten Ausbeute und nachfolgender aufwendiger Trennverfahren, in der Regel die kinetische Racematspaltung, die Kosten erheblich. Ebenso ist der Umgang mit Cyanid aufgrund von dessen Toxizität problematisch. Einige Strecker-Synthesen haben sich dennoch in der technischen Großproduktion durchgesetzt, da die Edukte (insbesondere Ammoniak und Cyanwasserstoff) teilweise sehr preiswert sind und es immer noch auf diesen Synthesenweg ausgerichtete alte Anlagen gibt. Die Bucherer-Bergs-Reaktion ist beispielsweise eine eingesetzte Variante.
Es existieren auch asymmetrische Strecker-Synthesen.[2][3] In der Variante von Kunz et al. verwendet man einen chiralen 1-Aminozucker (β-D-Galactosamin) statt Ammoniak dessen asymmetrische Induktion ausreicht, um befriedigende Enantiomerenüberschüsse zu erzielen.
Einen weiteren interessanten Zugang zur asymmetrischen Variante der Streckersynthese entwickelte die Arbeitsgruppe um Enders. Sie benutzen SAMP-Hydrazone als asymmetrische Induktion bei der Addition des Cyanids.[4]
Siehe auch
Quellen
Wikimedia Foundation.