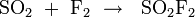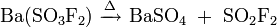- Sulfurylfluorid
-
Strukturformel 
Allgemeines Name Sulfuryldifluorid Andere Namen Sulfurylfluorid
Summenformel SO2F2 CAS-Nummer 2699-79-8 PubChem 17607 Kurzbeschreibung farbloses, geruchloses, giftiges Gas Eigenschaften Molare Masse 102,06 g·mol−1 Aggregatzustand gasförmig
Dichte 4,6261 kg·m−3[1]
Schmelzpunkt −135,8 °C[1]
Siedepunkt −55,4 °C[1]
Dampfdruck 15,5 bar (20 °C); 32 bar (50 °C)[1]
Löslichkeit wenig löslich[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23-48/20-50 S: (1/2)-45-63-60-61 MAK 21 mg·m−3[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Sulfuryldifluorid, auch Sulfurylfluorid, ist ein farb- und geruchloses Gas, das überwiegend zur Bekämpfung von Holzschädlingen in einzelnen Gegenständen, Räumen oder ganzen Gebäuden eingesetzt wird.
Inhaltsverzeichnis
Geschichte
Sulfuryldifluorid wird seit Anfang der 1950er-Jahre als Begasungsmittel zur Vernichtung von Holzschädlingen entwickelt und seit 1961 in den USA vertrieben.
Mit der Verabschiedung des Montreal-Protokolls im Jahr 1987 wurde der Einsatz des Schädlingsbekämpfungsmittels Methylbromid eingeschränkt, da es die Ozonschicht schädigt. Dadurch erweiterte sich der Einsatzbereich von Sulfuryldifluorid, das keine Wirkung auf die Ozonschicht hat.[4] Nach neueren atmosphärischen Messungen wird jedoch ein berechnetes Treibhauspotential von 4780 vermutet.[5]
Gewinnung und Darstellung
Sulfuryldifluorid kann durch Umsetzung von Schwefeldioxid und Fluor erhalten werden:[6]
Alternativ kann es über das Bariumsalz der Fluoroschwefelsäure dargestellt werden:[6]
Physikalische Eigenschaften
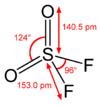 Sulfuryldifluorid ist (verzerrt) tetraedisch aufgebaut, das Schwefelatom sitzt hierbei in der Tetraedermitte.[7] Die Bindungslängen der Atombinungen sind im Bild dargestellt.
Sulfuryldifluorid ist (verzerrt) tetraedisch aufgebaut, das Schwefelatom sitzt hierbei in der Tetraedermitte.[7] Die Bindungslängen der Atombinungen sind im Bild dargestellt.
Chemische EigenschaftenIm Vergleich zu Sulfuryldichlorid ist Sulfuryldifluorid deutlich reaktionsträger und auch thermisch stabiler. So erfolgt z.B. in Wasser bei Raumtemperatur (je nach pH-Wert) gar keine oder nur langsame Hydrolyse zu HF und Schwefelsäure.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 2699-79-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 7. Oktober 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 2699-79-8 im European chemical Substances Information System ESIS
- ↑ BMWA Österreich: Stoffliste der MAK- und TRK-Werte, Anhang I/2007
- ↑ Arbeitsgemeinschaft Getreideforschung e.V. : Neue Begasungsmittel
- ↑ V. C. Papadimitriou et. al.: Experimental and Theoretical Study of the Atmospheric Chemistry and Global Warming Potential of SO2F2. In: J. Phys. Chem. A, 2008, 112, 12657–12666, doi:10.1021/jp806368u
- ↑ a b Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 592
- ↑ Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 590
Weblinks
- Angermeier's Schädlingsbekämpfung : Sulfuryldifluorid - ein neuzeitliches Begasungsmittel
- Erste Hilfe bei Vergiftungen mit Sulfuryldifluorid, Merkblatt des Hamburger Amtes für Arbeitsschutz
Wikimedia Foundation.