- Sulfuryldifluorid
-
Strukturformel 
Allgemeines Name Sulfuryldifluorid Andere Namen Sulfurylfluorid
Summenformel SO2F2 CAS-Nummer 2699-79-8 PubChem 17607 Kurzbeschreibung farbloses, geruchloses, giftiges Gas[1]
Eigenschaften Molare Masse 102,06 g·mol−1 Aggregatzustand gasförmig
Dichte 4,63 kg·m−3[1]
Schmelzpunkt Siedepunkt −55,4 °C[1]
Dampfdruck Löslichkeit wenig löslich[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 



Gefahr
H- und P-Sätze H: 331-373-400 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 23-48/20-50 S: (1/2)-45-63-60-61 MAK 21 mg·m−3[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Sulfuryldifluorid, auch Sulfurylfluorid, ist ein farb- und geruchloses Gas, das überwiegend zur Bekämpfung von Holzschädlingen in Gegenständen, Räumen oder Gebäuden dient.
Inhaltsverzeichnis
Geschichte
Sulfuryldifluorid wurde Anfang der 1950er-Jahre als Begasungsmittel zur Vernichtung von Holzschädlingen entwickelt und wird seit 1961 in den USA vertrieben.
Mit der Verabschiedung des Montreal-Protokolls im Jahr 1987 wurde der Einsatz des Schädlingsbekämpfungsmittels Methylbromid eingeschränkt, da es die Ozonschicht schädigt. Dadurch erweiterte sich der Einsatzbereich von Sulfuryldifluorid, das keine Wirkung auf die Ozonschicht hat.[4] Nach neueren atmosphärischen Messungen wird jedoch ein berechnetes Treibhauspotential von 4780 vermutet.[5]
Gewinnung und Darstellung
Sulfuryldifluorid kann durch Umsetzung von Schwefeldioxid und Fluor erhalten werden:[6]
Alternativ kann es über das Bariumsalz der Fluorsulfonsäure dargestellt werden:[6]
Ebenso gelingt die Metathese von Sulfurylchlorid mit Natriumfluorid:
Eigenschaften
Physikalische Eigenschaften
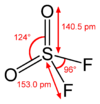
Sulfuryldifluorid ist bisphänoid (verzerrt tetraedisch) aufgebaut, das Schwefelatom sitzt hierbei in der Tetraedermitte.[7] Die Bindungslängen der Atombindungen sind im Bild dargestellt.
Chemische Eigenschaften
Im Vergleich zu Sulfurylchlorid ist Sulfurylfluorid deutlich reaktionsträger und thermisch stabiler. In Wasser bei Raumtemperatur hydrolysiert es je nach pH-Wert gar nicht oder nur langsam zu HF und Schwefelsäure.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 2699-79-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2007 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 2699-79-8 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ BMWA Österreich: Stoffliste der MAK- und TRK-Werte, Anhang I/2007.
- ↑ Arbeitsgemeinschaft Getreideforschung e.V.: Neue Begasungsmittel.
- ↑ V. C. Papadimitriou et. al.: Experimental and Theoretical Study of the Atmospheric Chemistry and Global Warming Potential of SO2F2. In: J. Phys. Chem. A, 2008, 112, S. 12657–12666, doi:10.1021/jp806368u.
- ↑ a b Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 592.
- ↑ Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter Verlag; 102., stark umgearb. u. verb. Auflage 2007; ISBN 978-3-11-017770-1; S. 590.
Weblinks
- Dr. Deniz Baltaci: Zum Vorratsschutz mit Gasen - Kohlenstoffdioxid zum Qualitätserhalt bei Feigen und Sulfurylfluorid gegen vorratsschädliche Insekten, Dissertation, Universität Rostock, November 2008
- Angermeier's Schädlingsbekämpfung : Sulfuryldifluorid - ein neuzeitliches Begasungsmittel
- Erste Hilfe bei Vergiftungen mit Sulfuryldifluorid, Merkblatt des Hamburger Amtes für Arbeitsschutz (PDF-Datei; 58 kB)
Kategorien:- Umweltgefährlicher Stoff
- Giftiger Stoff
- Gesundheitsschädlicher Stoff
- Fluorverbindung
- Schwefelverbindung
- Insektizid
- Biozid (Wirkstoff)
Wikimedia Foundation.