- Tissue Engineering
-
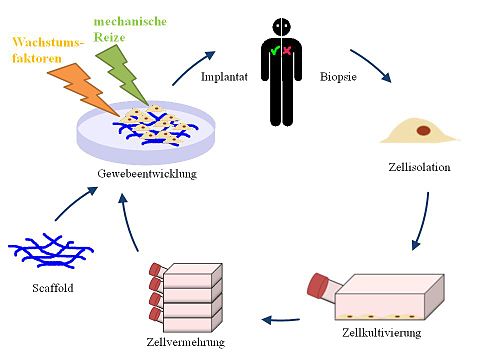
Tissue Engineering (TE) (engl. Gewebekonstruktion bzw. Gewebezüchtung) ist der Überbegriff für die künstliche Herstellung biologischer Gewebe durch die gerichtete Kultivierung von Zellen, um damit kranke Gewebe bei einem Patienten zu ersetzen oder zu regenerieren. Hierfür werden üblicherweise Zellen dem Spender-Organismus entnommen und im Labor in vitro vermehrt. Je nach Zellart können diese als Zellrasen zweidimensional oder mittels bestimmten Zell-Gerüsten dreidimensional kultiviert werden. Anschließend können sie dem Empfänger (re-)transplantiert werden.[1]. Diese können dann in meist denselben Organismus implantiert werden und so eine Gewebefunktion erhalten oder wiederherstellen. Tissue Engineering Produkte (TEP) gehören zur Gruppe der Arzneimittel für neuartige Therapien und sind eine der Anwendungsbeispiele für die regenerative und personalisierte Medizin.
„Tissue Engineering ist die Anwendung von Prinzipien und Methoden der Ingenieur-, Werkstoff- und Lebenswissenschaften zur Gewinnung eines fundamentalen Verständnisses von Struktur-Funktions-Beziehungen in normalen und pathologischen Säuger-Geweben; und die Entwicklung von biologischem Ersatz zur Erneuerung, Bewahrung oder Verbesserung der Gewebefunktion“[2]. Im engeren Sinne versteht man darunter die Zellentnahme am Patienten zur Züchtung des gewünschten Organs.Das Tissue Engineering beinhaltet vier Elemente, nämlich
- ein strukturelles Gerüst (optional, oft Scaffold genannt)
- lebende Zellen oder Gewebe
- die Kontrolle der Signaltransduktion an den lebenden Bestandteil (Wachstumsfaktoren)
- ein Kulturmedium (Nährlösung) bzw. Organismus.
Das Gerüst biologischer oder synthetischer Art wird vor der Kultur mit dem entnommenen vitalen Material kombiniert. Die Kultivierung kann sowohl im Körper (in vivo- Tissue Engineering) als auch im Labor (in vitro- Tissue Engineering) erfolgen. In beiden Fällen erfolgt idealerweise eine Kontrolle der Signalstoffe, die die Zelle erreichen, sodass die Bildung des neuen Gewebes unterstützt wird.
Die bioartifiziellen Regenerate oder Konstrukte werden wieder in die Zielregion des Organismus implantiert. Der Vorteil bei einem solchen Implantat mit autologem (patienteneigenem) Zellanteil besteht darin, dass es vom Immunsystem des Patienten akzeptiert wird, denn die kultivierten Zellen weisen nur solche Proteine auf den Zelloberflächen auf, die das Immunsystem als „eigene“ erkennt. Damit sollten Tissue-Engineering-Implantate normalerweise nicht abgestoßen werden. Ein gutes Beispiel dafür ist die Herstellung von vollkommen autologen Herzklappen[3] oder Gefäßprothesen[4], welche dann zum Einsatz kommen wenn beispielsweise eine verstopfte Arterie nicht durch eine körpereigene Vene ersetzt werden kann. In einem solchen Fall kommt in der Regel eine Kunststoffprothese zum Einsatz, welche eine unbefriedigende Alternative darstellen. .
Bei den bisher erfolgreichen TE-Ansätzen handelt es sich ausschließlich um Gewebe aus einer einzigen Zellart. Besonders geeignet für die Gewebekultur ist Knorpelgewebe, da Knorpel schon im lebenden Körper aus einer einzigen Zellart besteht, nur durch die Gelenkflüssigkeit ernährt wird und sein Gerüst aus Kollagenfasern und Proteoglykanen selber herstellt. Andere wichtige, ja lebenswichtige Gewebe, wie z.B. Leber- oder Nierenparenchym, sind so komplex in ihrem Aufbau, dass eine in-vitro-Züchtung bisher nicht erfolgreich ist. Um bei lebensgefährdenden Erkrankungen die Wirksamkeit der spezifischen Organzellen nutzen zu können, werden die Parenchymzellen bisher in Dialysesystemen dem Blutstrom ausgesetzt. Für Tissue-Engineering von funktionsfähigen Organen müssten neben den Parenchymzellen (z.B. Hepatozyten) auch Stützgewebe, Blutgefäße und Gallegefäße, möglicherweise auch Lymphgefäße gezüchtet werden. Cokulturen solch unterschiedlicher Zelltypen sind eine Herausforderung für die Zukunft. Cokulturen sind bisher für Chondrozyten und Osteoblasten gemeinsam experimentell durchgeführt worden. Bevor diese Probleme der Cokultur nicht gelöst sind, wird TE die großen Ziele der Organzüchtung lebenswichtiger Organe nicht erreichen. Erst dann werden Transplantationen von Spenderorganen durch die gezielte Züchtung von Organen mit Hilfe von körpereigenen Zellen ersetzt. [5]
Eine weitere wichtige Anwendung des Tissue Engineering ist die Anwendung in der Grundlagenforschung. Dem natürlichen Gewebe nachempfundene Konstrukte dienen dort zur Aufklärung zellulärer Mechanismen. Darüber hinaus ermöglichen die Methoden des TE die Herstellung dreidimensionaler gewebeähnlicher Zellkonstrukte, an denen sich die Wirkung von Schadstoffen (z. B. Pestiziden), aber auch die Wirkung von Pharmazeutika testen lässt.[6].
Das Problem der Gewebezüchtung liegt darin, dass spezifizierte Zellen ihre Funktionalität verlieren (Dedifferenzierung). Eine Tierversuchsstudie bei adulten Schafen, in die autologe Gefäßprothesen implantiert wurden [7], zeigte bis zum Versuchsende durchgängige Gefäße, die ein solides Gewebe aufbauten. Bisher ist es gelungen, Haut-[8] und Knorpelgewebe[9] sowie Blutgefäße[10] zur kommerziellen Anwendung zu züchten.
Dabei werden zumeist bereits ausdifferenzierte Zellen aus dem Organismus in vitro vermehrt. Ein neuer Ansatz ist die Verwendung von adulten oder induzierten pluripotenten Stammzellen (iPS). Die adulten Zellen können aus dem Knochenmark oder inneren Organen von erwachsenen Personen gewonnen und die iPS durch Rückprogrammierung von Zellen erzeugt werden (z. B. Fibroblasten aus der Haut). Die Stammzellen können im Kulturbehälter vermehrt und danach durch Chemikalien zu bestimmten benötigten Zelltypen differenziert werden.
Motor für die Entwicklung des Tissue Engineering ist der steigende Bedarf an sicheren Ersatzgeweben und -organen sowie die Grundlagenforschung.
Allgemein werden hier vier Arten von Implantaten unterschieden:
- von anderen Lebewesen stammende (xenogen) – z. B. Herzklappen
- von einem Individuum gleicher Spezies (allogen) – z. B. Niere
- vom Patienten selbst (autolog) – z. B. Haut
- von genetisch identischen Individuen (syngen) – wie z. B. von eineiigen Zwillingen [11]
Eine weitere Anwendung findet sich möglicherweise zukünftig in der biotechnologischen Herstellung von In-Vitro-Fleisch, um Massentierhaltung und die damit verbundenen Probleme zu umgehen.
Weblinks
- Helmholtz-Institut - RWTH Aachen und Universitätsklinikum Aachen - Institut für Angewandte Medizintechnik - Medizinische Fakultät - Cardiovasculäres Tissue Engineering
- Tissue Engineering der Charité Universitätsmedizin Berlin
- Arbeitsgruppe Prof. Minuth Universität Regensburg
- Forschungsbereich des Translationszentrums für Regenerative Medizin (TRM) Leipzig
- Tissue Engineering - Labor Technische Universität Hamburg-Harburg Bioverfahrenstechnik
- Tissue Engineering Gelenkknorpel / Wachstumsfungenknorpel Osteologie-Biomechanik UKE
Einzelnachweise
- ↑ Toni Lindl, Gerhard Gstraunthaler: Zell- und Gewebekultur: Von den Grundlagen zur Laborbank. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1776-3.
- ↑ Richard Skalak (Hrsg.): Tissue Engineering. Liss, New York 1988, ISBN 0-8451-4706-4.
- ↑ autologe Herzklappen
- ↑ Gefäßprothesen
- ↑ Meenen NM Tissue engineering- eine Standortbestimmung ZOrthop Unfall 2008; 146: 19–20
- ↑ K. Andreas, C. Lübke, T. Häupl u.a.: Key regulatory molecules of cartilage destruction in rheumatoid arthritis: an in vitro study (Zentrale regulatorische Moleküle der Knorpelzerstörung in Rheumatoider Arthritis: eine in-vitro-Studie). In: Arthritis research and therapy. Ausgabe v10n1 vom 18. Januar 2008. BioMed Central, London 2008
- ↑ Koch S, Flanagan TC, Sachweh JS, Tanios F, Schnoering H, Deichmann T, Ellä V, Kellomäki M, Gronloh N, Gries T, Tolba R, Schmitz-Rode T, Jockenhoevel S.: Fibrin-polylactide-based tissue-engineered vascular graft in the arterial circulation, Biomaterials. 2010 Jun;31(17):4731-9. Epub 2010 Mar 20 [1].
- ↑ Kuroyanagi Y, Kenmochi M, Ishihara S, Takeda A, Shiraishi A, Ootake N, Uchinuma E, Torikai K, Shioya N.: A cultured skin substitute composed of fibroblasts and keratinocytes with a collagen matrix: preliminary results of clinical trials (Ein aus Fibroblasten, Keratinozyten und Kollagenmatrix hergestellter kultivierter Hautersatz: Vorergebnisse einer klinischen Studie) Ann Plast Surg. 1993 Oct;31(4):340-9; discussion 349-51.
- ↑ Haisch A, Schultz O, Perka C, Jahnke V, Burmester GR, Sittinger M.: Tissue Engineering von humanem Knorpelgewebe für Wiederherstellungschirurgie mithilfe biokompatiblem Fibringelen und Polymerträgern [Tissue engineering of human cartilage tissue for reconstructive surgery using biocompatible resorbable fibrin gel and polymer carriers]. HNO. 1996 Nov;44(11):624-9
- ↑ Liu SQ.: Prevention of focal intimal hyperplasia in rat vein grafts by using a tissue engineering approach.Atherosclerosis. 1998 Oct;140(2):365-77.
- ↑ Erich Wintermantel, Suk-Woo Ha: Medizintechnik mit biokompatiblen Werkstoffen und Verfahren. Springer Verlag, Berlin Heidelberg New York 2002, ISBN 3-540-41261-1.
Wikimedia Foundation.