- UNIQUAC
-
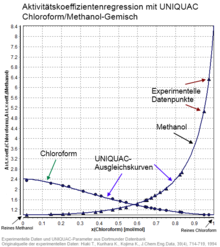
UNIQUAC[1] (Abk. für englisch Universal Quasichemical) ist ein Aktivitätskoeffizientenmodell, das die Aktivitätskoeffizienten γ der Komponenten in einem chemischen Gemisch mit den Zusammensetzungen, ausgedrückt durch Molenbrüche xi, korreliert.
Inhaltsverzeichnis
Gleichungen
In UNIQUAC wird der Aktivitätskoeffizient der Komponente i aus zwei Bestandteilen zusammengesetzt, dem Restanteil, der intermolekulare Kräfte beschreibt, und dem kombinatorischen Anteil, der Größe und Form der Komponenten berücksichtigt:
Kombinatorischer Anteil
Der kombinatorische Anteil γC wird ausschließlich aus stoffspezifischen Größen berechnet, den relativen van der Waalschen Volumina ri und Oberflächen qi der reinen Stoffe.
mit dem Volumenanteil pro Molanteil Vi der Komponente i
und dem Oberflächenanteil pro Molanteil Fi der Komponente i
Restanteil
Der Restanteil hingegen enthält Wechselwirkungsparameter, die an experimentell und manchmal auch abgeschätzte Aktivitätskoeffizienten angepasst werden.
mit
Δuij sind die anpassbaren Wechselwirkungsparameter zwischen den Komponenten i und j.
Verwendung
Aktivitätskoeffizienten erlauben es, über einfache Beziehungen Phasengleichgewichte (gasförmig-flüssig, flüssig-flüssig, fest-flüssig) und einige weitere thermodynamische Größen zu berechnen. Modelle wie UNIQUAC erlauben es nun, beispielsweise in der Prozesssimulation komplexe Berechnungen für beliebige Zusammensetzungen eines chemischen Gemischs mit nur wenigen bekannten Parametern durchzuführen, ohne experimentelle Daten für alle benötigten Punkte kennen zu müssen.
Parameter
UNIQUAC kennt zwei grundsätzlich unterschiedliche Parameter.
- Relative van der Waalsche Oberflächen und Volumina sind Stoffkonstanten, die für alle beteiligten Stoffe bekannt sein müssen.
- Wechselwirkungsparameter zwischen zwei Komponenten, die die intermolekularen Kräfte beschreiben. Diese Parameter müssen für alle binären Paare in einem Gemisch bestimmt werden. In einem quaternären Gemisch sind dies bereits sechs Parametersätze (1-2, 1-3, 1-4, 2-3, 2-4, 3-4) und diese Zahl steigt stark an mit weiteren Komponenten. Die Wechselwirkungsparameter selber werden an experimentelle Aktivitätskoeffizienten oder an Phasengleichgewichtsdaten, aus denen Aktivitätskoeffizienten abgeleitet werden können, angepasst. Eine Alternative ist außerdem, Aktivitätskoeffizienten mit einem Abschätzverfahren wie UNIFAC zu ermitteln und UNIQUAC-Parameter an diese abgeschätzten Aktivitätskoeffizienten anzupassen. Der Vorteil der UNIQUAC-Parameter ist die deutliche einfachere und damit schnellere Berechnung gegenüber der direkten Verwendung des recht komplexen Vorhersageverfahrens.
Neuere Entwicklungen
UNIQUAC wird in vielen Arbeitsgruppen weiterentwickelt. Einige ausgewählte Derivate sind
- UNIFAC: Ein Verfahren, dass erlaubt, sowohl die Volumina und Oberflächen als auch insbesondere auch die Wechselwirkungsbeiträge abzuschätzen. Dies erübrigt die Verwendung von experimentellen Daten zur Anpassung der UNIQUAC-Parameter.
- Erweiterungen für die Berechnung von Aktivitätskoeffizienten in elektrolythaltigen Gemischen[2]
- Erweiterungen zur besseren Beschreibung der Temperaturabhängigkeit von Aktivitätskoeffizienten[3]
- Erweiterungen für Polymersysteme[4]
Einzelnachweise
- ↑ Denis S. Abrams, John M. Prausnitz: Statistical thermodynamics of liquid mixtures: A new expression for the excess Gibbs energy of partly or completely miscible systems. In: AIChE Journal. 21, Nr. 1, 1975, S. 116–128, doi:10.1002/aic.690210115.
- ↑ Maria C. Iliuta, Kaj Thomsen, Peter Rasmussen: Extended UNIQUAC model for correlation and prediction of vapour-liquid-solid equilibria in aqueous salt systems containing non-electrolytes. Part A. Methanol-water-salt systems. In: Chemical Engineering Science. 55, Nr. 14, 2000, S. 2673–2686, doi:10.1016/S0009-2509(99)00534-5.
- ↑ Barbara Wisniewska-Goclowska, Stanislaw K. Malanowski: A new modification of the UNIQUAC equation including temperature dependent parameters. In: Fluid Phase Equilibria. 180, Nr. 1-2, 2001, S. 103–113, doi:10.1016/S0378-3812(00)00514-8.
- ↑ João A. P. Coutinho, Fernando L. P. Pessoa: A modified extended UNIQUAC model for proteins. In: Fluid Phase Equilibria. 222-223, 2004, S. 127–133, doi:10.1016/j.fluid.2004.06.030.
Wikimedia Foundation.