- UO2F2
-
Strukturformel 
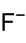
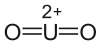
Allgemeines Name Uranylfluorid Andere Namen Difluordioxiuran
Summenformel (UO2)F2 CAS-Nummer 13536-84-0 PubChem 26096 Kurzbeschreibung leuchtend orange, mit Wasser gelbe Kristalle Eigenschaften Molare Masse 308,02 g·mol−1 Aggregatzustand fest
Schmelzpunkt (keiner, zersetzt sich ab 300 °C)
Siedepunkt (sublimiert)
Löslichkeit sehr gut in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 26/28-33-51/53 S: (1/2)-20/21-45-61 Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Uranylfluorid (UO2)F2 ist eine Uranverbindung, die ein Zwischenprodukt bei der Umwandlung von Uranhexafluorid UF6 in ein Uranoxid oder in die metallische Form des Urans ist, es entsteht ferner bei der Reaktion von UF6 mit Luftfeuchtigkeit.
Inhaltsverzeichnis
Eigenschaften
In Wasser ist Uranylfluorid sehr gut löslich. Außerdem ist es hygroskopisch und ändert durch Wasseraufnahme die Farbe von leuchtendem orange nach gelb. Es ist an der Luft bis 300 °C stabil, danach beginnt die langsame Zersetzung zu Yellowcake (Triuranoctoxid) U3O8. Erhitzt man Uranylfluorid bis zur Zersetzung, emittiert es auch toxische Fluordämpfe.
Sicherheitshinweise
Bei zufälliger Freisetzung von UF6, kann sich (UO2)F2 als Feststoff in Partikeln im Boden anreichern. Es zersetzt sich gemäß: UF6 + 2 H2O → UO2F2 + 4 HF. Diese Reaktion kann immer stattfinden, egal ob das Uranhexafluorid fest oder gasförmig vorliegt. Jedoch findet sie unverzüglich statt, wenn das UF6 als Gas vorliegt. Die dabei entstehende Flusssäure reagiert mit Wasser zu Feststoffen, welche aus Fluorwasserstoffaddukten von hydrolysiertem Uranylfluorid (UO2F2 · n H2O) bestehen.
Giftigkeit
Chemische Gifte sind weit gefährlicher als radioaktive Gifte, obwohl man gewisse Strahlenschutzvorkehrungen treffen sollte, wenn angereichertes Uran (U-235) in der Verbindung vorhanden ist. Das Material korrodiert schnell und ist gefährlich beim Einatmen, bei der oralen Einnahme oder Hautresorption. Eine Inkorporation durch Inhalation oder Verschlucken kann sich verheerend auf den Organismus auswirken. Die Folgen können mit Verzögerung auftreten.
Einzelnachweise
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Uranverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2009 (JavaScript erforderlich)
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- W. L. Myers: A literature review on the chemical and physical properties of uranyl fluoride, Appendix A of the PEIS (DOE/EIS-0269) (Los Alamos National Lab., NM (USA) Illinois Univ. Urbana, IL (USA).
Wikimedia Foundation.

