- Vertico-SMI
-
Das Vertico-SMI ist ein Fluoreszenzmikroskop für die dreidimensionale Aufnahme von Zellen im Nanometerbereich (Super Resolution). Im Unterschied zu vergleichbaren Ansätzen erfolgt die Markierung mit normalen Fluoreszenzfarbstoffen wie GFP, Cy2/3, Fluorescein, Alexa- und Attofarbstoffen. Es basiert auf zwei Mikroskoptechnologien, welche 1996 entwickelt wurden, der Lokalisationsmikroskopie SPDM und der Strukturierten Beleuchtung SMI. Die effektive optische Auflösung dieses optischen Nanoskopes erreicht 5 nm in 2D und 40 nm in 3D und ist dadurch deutlich besser als die physikalische Auflösungsgrenze von 200 nm, postuliert durch das Gesetz von Abbe 1873. [1]
Inhaltsverzeichnis
Namensherkunft
„SMI“ steht für eine spezielle Art der laseroptischen Beleuchtung (Spatially Modulated Illumination, Räumlich Strukturierte Beleuchtung) und „Vertico“ für die vertikale Anordnung der Mikroskopachse, die es ermöglicht, fixierte Zellen, aber auch lebende Zellen mit einer dreidimensionalen effektiven optischen Auflösung von 40 Nanometer (1 Nanometer = 1 nm = 1 × 10−9 m) zu analysieren.
Grundlagen
Das Mikroskop wurde von Christoph Cremer, Professor für Angewandte Optik und Informationsverarbeitung an der Universität Heidelberg entwickelt. Es basiert auf einer Kombination von lichtoptischen Techniken der Lokalisationsmikroskopie (SPDM, Spectral Precision Distance Microscopy) und strukturierter Beleuchtung (SMI, Spatially Modulated Illumination). Eine Besonderheit im Unterschied zu fokussierenden Techniken wie der 4Pi-Mikroskopie sind die Weitfeldaufnahmen, mit denen man ganze Zellen nanoskopisch aufnehmen kann. Für 3D-Aufnahmen solcher ganzen Zellen mit typischen Bildfeldern der Größe 20 µm × 20 µm werden nur 2 Minuten benötigt. Weitfeldaufnahmen bedeutet, dass man die ganze Probe gleichzeitig beleuchtet und detektiert.
- SPDMphymod: Superresolution Mikroskopie mit normalen Fluoreszenzmolekülen: GFP, RFP, YFP
Spatially Modulated Illumination (SMI)
Spatially Modulated Illumination (SMI) steht für räumlich strukturierte Beleuchtung. Die SMI-Mikroskopie ist ein lichtoptisches Verfahren des sogenannten Point Spread Function-Engineering. Darunter sind Verfahren zu verstehen, die die Punktbild-Funktion (Point Spread Function, PSF) eines Mikroskops in geeigneter Weise modifizieren, um entweder die optische Auflösung zu erhöhen, die Präzision von Distanzmessungen an punktförmigen, d. h., im Vergleich zur Wellenlänge kleinen fluoreszierenden Objekten zu maximieren, oder andere Strukturparameter im Nanometerbereich zu extrahieren.
Beim gegenwärtig am Kirchhoff-Institut für Physik der Universität Heidelberg entwickelten SMI-Mikroskop wird dies dadurch erreicht, dass die Anregungsintensität im Objektraum im Gegensatz zu herkömmlichen Weitfeldfluoreszenz-Mikroskopen nicht homogen ist, sondern durch Verwendung zweier gegenläufiger, interferierender Laserstrahlen in axialer Richtung räumlich präzise moduliert wird. Das Prinzip des räumlich modulierten Wellenfeldes wurde 1993 von Bailey et al. entwickelt. Bei dem Heidelberger SMI Mikroskopieansatz wird das Objekt in hochpräzisen Schritten durch das Wellenfeld bewegt, oder es wird das Wellenfeld selbst verschoben (Phase). Daraus resultiert eine Erhöhung der axialen Größen- und Distanzauflösung.
Spectral Precision Distance Microscopy (SPDM)
SPDM (Spektrale Präzisions-Distanz-Mikroskopie) ist ein lichtoptisches Verfahren der Fluoreszenzmikroskopie, mit welchem an „optisch isolierte“ Teilchen (z. B. einzelne Moleküle) Positions-, Abstands- und Winkelmessungen weit unterhalb der optischen Beugungsbegrenzung möglich sind. „Optisch isoliert“ bedeutet, dass zu einem bestimmten Zeitpunkt nur ein einziges Teilchen/Molekül in einem durch die konventionelle optische Auflösung festgelegten Gebiet (typischerweise ca. 200–250 nm Durchmesser) registriert wird. Dies ist möglich, wenn die in einem solchen Gebiet befindlichen Teilchen/Moleküle unterschiedliche spektrale Markierungen tragen (z. B. verschiedene Farben haben, oder andere nutzbare Unterschiede in der Lichtemission zeigen).
Die mit SPDM mögliche Strukturauflösung kann angegeben werden durch die kleinste messbare Distanz zwischen zwei in ihrer räumlichen Position bestimmten „punktförmigen“ Teilchen unterschiedlicher spektraler Markierung („Topologische Auflösung“). Simulationsrechnungen haben gezeigt, dass unter geeigneten Annahmen über Lokalisationsgenauigkeit, Teilchendichte etc. die „topologische Auflösung“ einer Raumfrequenz entspricht, die einer stark erhöhten optischen Auflösung im Sinne der klassischen Definition äquivalent ist.
Es handelt sich um eine Lokalisationsmikroskopie, wodurch eine effektive optische Auflösung möglich gemacht wird, die um ein Vielfaches besser ist als die konventionelle optische Auflösung (ca. 200–250 nm), gegeben durch die Halbwertsbreite des Hauptmaximums der effektiven Punktbildfunktion. Durch geeignete laseroptische Präzisionsverfahren werden Positionen und Distanzen erheblich kleiner als die Halbwertsbreite der PSF zwischen Targets verschiedener spektraler Signatur nanometergenau vermessen. Ein wichtiges Einsatzgebiet ist die Genomforschung (Studium der funktionellen Organisation des Genoms). Ein weiteres wesentliches Anwendungsgebiet ist die Membranstrukturforschung.
Auflösung
Die effektive optische Auflösung dieses optischen Nanoskops hat einen Bereich von 10 nm in 2D und 40 nm in 3D erreicht und liegt daher wesentlich unter der physikalischen Grenze von 200 nm, welche durch das Gesetz von Abbe 1873 als die physikalische Grenze, unterhalb der eine lichtmikroskopische Auflösung theoretisch nicht möglich ist, postuliert worden ist.[2]
Die 3D-Aufnahmen mit dem Vertico-SMI sind möglich durch eine Kombination von SMI und SPDM, wobei zuerst das SMI- und danach das SPDM-Verfahren durchgeführt wird. Mit dem SMI-Verfahren wird der Schwerpunkt der Orte der Teilchen und ihre „Verschmierung“ in Richtung der Mikroskopachse bestimmt. Während der Schwerpunkt der Teilchen/Moleküle mit einer Präzision von 1–2 nm bestimmt werden kann, kann die „Verschmierung“ um diesen Schwerpunkt bis zu einem axialen Durchmesser von ca. 30–40 nm vermessen werden.
Anschließend wird mit SPDM die laterale Position der einzelnen Teilchen/Moleküle mit einer Lokalisationsgenauigkeit von wenigen Nanometern vermessen. Zum gegenwärtigen Zeitpunkt werden bei SPDM 16 frames/s bei einer effektiven optischen Auflösung von 10 nm in 2D (Objektebene) erzielt; ca. 2000 solcher frames wurden mit SMI Daten (zurzeit ca. 10 s Gesamtaufnahmezeit) kombiniert, um ein höchstaufgelöstes dreidimensionales (3D) Bild zu erhalten (effektive optische 3D-Auflösung ca. 40–50 nm). Mit einer schnelleren Kamera sind noch höhere Raten zu erwarten (bis mehrere hundert frames/s, derzeit in Vorbereitung). Mit geeigneten Farbstoffen sollte eine noch wesentlich höhere effektive optische 3D-Auflösung möglich sein.[3][4]
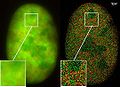
GFP Superresolution „Blinkende Farbstoffe“ statt photoschaltbarer Moleküle
In den letzten beiden Jahren wurden in der optischen Nanoskopie erstmals in derselben Spektralfarbe leuchtende Moleküle eingesetzt (aber mit verschiedener spektraler Signatur aufgrund von „Blink“-Eigenschaften), die durch Licht in der für die spektrale Präzisionsdistanzmikroskopie erforderlichen Weise an- und abgeschaltet werden können. Durch die Kombination vieler tausender Einzelaufnahmen derselben Zelle wurden mithilfe von laseroptischen Präzisionsmessungen „Lokalisationsbilder“ mit wesentlich verbesserter optischer Auflösung gewonnen. Cremers Arbeitsgruppe fand 2008 heraus, dass dies unter bestimmten photophysikalischen Bedingungen auch für viele „ganz gewöhnliche“ Farbstoffmoleküle wie GFP oder Alexa-Farbstoffen realisiert werden kann. Dies erweitert die Anwendbarkeit der SPDM-Methode auf zahlreiche Gebiete der biophysikalischen, zellbiologischen und medizinischen Forschung.[5]
Einzelnachweise
- ↑ : High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy. In: Chromosome research : an international journal on the molecular, supramolecular and evolutionary aspects of chromosome biology. 16, Nr. 3, 2008, S. 367–82. doi:10.1007/s10577-008-1238-2. PMID 18461478.
- ↑ Jürgen Reymann, David Baddeley, Manuel Gunkel, Paul Lemmer, Werner Stadter, Thibaud Jegou, Karsten Rippe, Christoph Cremer, Udo Birk: High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy. In: Chromosome Research. 16, Nr. 3, 2008, S. 367-382, doi:10.1007/s10577-008-1238-2, PMID 18461478.
- ↑ P. Lemmer, M. Gunkel, D. Baddeley, R. Kaufmann, A. Urich, Y. Weiland, J. Reymann, P. Müller, M. Hausmann, C. Cremer: SPDM: light microscopy with single-molecule resolution at the nanoscale. In: Applied Physics B. 93, Nr. 1, 2008, S. 1–12, doi:10.1007/s00340-008-3152-x.
- ↑ David Baddeley, Claudia Batram, Yanina Weiland, Christoph Cremer, Udo J. Birk: Nanostructure analysis using spatially modulated illumination microscopy. In: Nat. Protocols. 2, Nr. 10, September 2007, S. 2640–2646, doi:10.1038/nprot.2007.399.
- ↑ Manuel Gunkel, Fabian Erdel, Karsten Rippe, Paul Lemmer, Rainer Kaufmann, Christoph Hörmann, Roman Amberger, Christoph Cremer: Dual color localization microscopy of cellular nanostructures. In: Biotechnology Journal. 4, Nr. 6, 2009, ISSN 1860-6768, S. 927–938, doi:10.1002/biot.200900005.
Weblinks
- Heidelberger Innovationsforum 2009: Schnellstes Lichtmikroskop der Welt zur besten Geschäftsidee gekürt
- GFP Superresolution
- Publikationsliste zur Lichtoptischen Nanoskopie
- Pressemitteilung der Universität Heidelberg
- "Blinkende Farbstoffe" in Ruperto Carola, Forschungszeitschrift der Universität Heidelberg
Wikimedia Foundation.