- Xanthophyllzyklus
-
Übergeordnet Metabolismus der Xanthophylle Gene Ontology AmiGO QuickGO Der Xanthophyllzyklus, auch Violaxanthinzyklus, ist ein Schutzmechanismus des Photosyntheseapparates höherer Pflanzen und mancher Grünalgen. Er hilft, überschüssige Anregungsenergie als Wärme abzuführen, bevor sich reaktive Sauerstoffspezies bilden. Dadurch werden Schäden an den Antennenkomplexen des Photosystems II (PS II) minimiert. Der Xanthophyllzyklus ist ein wichtiger Schritt zur nichtphotochemischen Löschung der Excitonenenergie.[1]
Dazu kann es bei Überenergetisierung der Elektronentransportkette zum Beispiel durch zu starke Beleuchtung (Starklichtstress) kommen.
Inhaltsverzeichnis
Nicht-photochemische Löschung von Lichtenergie
Bei der Photosynthese wird die Energie des Lichtes genutzt. Die Photosyntheserate hängt dabei von der Lichtstärke ab, ist aber bis zu einem gewissen Grad limitiert. Bei hohen Lichtstärken liegen daher viele Chlorophyllmoleküle in den Antennenkomplexen angeregt vor, können aber bedingt durch die erschöpfte Photosynthesekapazität ihre Lichtenergie nicht in das Reaktionszentrum des Photosynthesesystems II (PS II) weiterleiten. Dies hat zur Folge, dass die angeregten Chlorophyllmoleküle reaktive Sauerstoffspezies (ROS) erzeugen, beispielsweise Singulett-Sauerstoff 1O2.[2] ROS beschädigen Pigmente, Proteine und Lipide der Thylakoidmembran und inhibieren dadurch die Photosynthese bzw. zerstören Photosynthesesysteme.
Um überschüssige Energie abzufangen, verwenden Pflanzen einen Schutzmechanismus: der Xanthophyllzyklus.
Biochemie
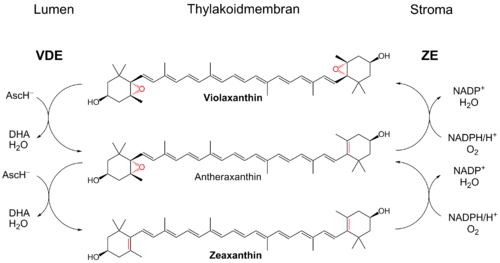 Übersicht über den Xanthophyllzyklus. Die Umwandlung von Zeaxanthin zu Violaxanthin wird von einer Zeaxanthin-Epoxidase (ZE), die Umkehrreaktionen von einer Violaxanthin-Deepoxidase (VDE) katalysiert. Die Enzyme liegen membrangebunden im Stroma bzw. Lumen des Chloroplasten vor. AscH− = Ascorbat; DHA = Dehydroascorbinsäure. Für Einzelheiten bitte Text beachten.
Übersicht über den Xanthophyllzyklus. Die Umwandlung von Zeaxanthin zu Violaxanthin wird von einer Zeaxanthin-Epoxidase (ZE), die Umkehrreaktionen von einer Violaxanthin-Deepoxidase (VDE) katalysiert. Die Enzyme liegen membrangebunden im Stroma bzw. Lumen des Chloroplasten vor. AscH− = Ascorbat; DHA = Dehydroascorbinsäure. Für Einzelheiten bitte Text beachten.
Violaxanthin-Deepoxidase (VDE)
Bei intensivem Licht werden in Folge einer effizienten Photosynthese viele Protonen in das Thylakoidlumen transloziert. Diese werden normalerweise für das Betreiben einer membrangebundenen ATP-Synthase verwendet. Bei hohen Lichtstärken jedoch wird dieser Protonengradient nicht schnell genug abgebaut, da der ATP-Bedarf der Pflanze gedeckt ist. Infolgedessen säuert sich das Lumen stark an (pH-Senkung). Dies aktiviert das Enzym Violaxanthin-Deepoxidase (EC 1.10.99.3), welches das Diepoxid Violaxanthin über das Monoepoxid Antheraxanthin zu Zeaxanthin reduziert. VDE ist ein kernkodiertes Enzym, welches im Lumen des Chloroplasten lokalisiert ist und ein pH-Optimum bei 5,0 besitzt.[3] In der Dunkelheit ist das Enzym inaktiv und liegt nicht membranassoziiert vor.
Für die Reduktion wird Ascorbat (AscH−) benötigt, welches auch das Enzym aktiviert. Dieses wird zu Dehydroascorbat (DHA) oxidiert, dabei wird auch Wasser freigesetzt. DHA kann im Lumen nicht zu Ascorbat regeneriert werden. Außerdem (AscH−) kann als Anion nicht einfach durch die Thylakoidmembran diffundieren. Möglicherweise existiert ein Transportersystem, welches Ascorbat in das und DHA aus dem Lumen transportiert.[4] Im Stroma kann DHA unter Verbrauch von NADPH und Glutathion zu Ascorbat reduziert werden.
Zeaxanthin-Epoxidase (ZE)
Die Rückreaktion von Zeaxanthin über Antheraxanthin zu Violaxanthin wird von einem anderen membranassoziierten Enzym katalysiert, die Zeaxanthin-Epoxidase (EC 1.14.13.90). Sie ist im Stroma lokalisiert und führt unter Verbrauch von Sauerstoff und NADPH jeweils eine Epoxidgruppe ein. Das pH-Optimum liegt bei dieser Monooxygenase bei 7,5. Die Reaktion findet bei Pflanzen im Dunkeln oder schwachen Licht statt, wurde aber auch für helles Licht beobachtet.[4] Für die Reaktion werden noch weitere Cofaktoren wie FAD und Ferredoxin benötigt.
VDE und ZE zählen zu den pflanzlichen Lipocalinproteinen und weisen gemeinsame strukturelle Ähnlichkeiten auf.
Bedeutung
Zum Schutze des Photosystems besitzen Pflanzen viele Möglichkeiten, jedoch zählen Carotinoide als die wichtigsten Schutzsysteme. Hierbei erlangt der Xanthophyllzyklus als nicht-konstitutiver Schutzmechanismus vor einem Überangebot an Lichtenergie die größte Bedeutung.[1] In den Lichtsammelkomplexen bindet Zeaxanthin an eine Untereinheit des LHCII, die unter den niedrigen pH-Wert protoniert vorliegt.[5] Dies ermöglicht effektiv die Aufnahme der Energie vom Chlorophyll im Triplettzustand (3Chl a*), welche dann als Wärme abgestrahlt wird. Das liegt daran, dass angeregtes Zeaxanthin eine nur kurze Lebenszeit von 10 ps hat.[2] Violaxanthin leitet dagegen Anregungsenergie an Chlorophyll weiter und fungiert so als akzessorisches Pigment. Eine hohe Anregung des PS II führt zu einem hohen pH-Gradienten, erst dadurch kann Zeaxanthin gebildet werden. Man schätzt, dass 50 bis 70% aller absorbierten Photonen durch den Zyklus in Wärme umgewandelt werden.[1]
Diadinoxanthinzyklus
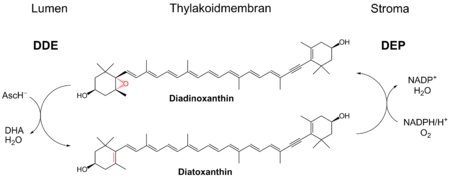
In Kieselalgen wird zur nicht-photochemischen Löschung ein ähnlicher Zyklus verwendet, bei dem anstatt Zeaxanthin Diatoxanthin (Dtx) verwendet wird. Dieses wird durch die Dtx-Epoixdase (DEP) zu Diadionoxanthin (Ddx) unter Verbrauch von NADPH und O2 umgesetzt. Diadionoxanthin entspricht daher funktionell dem Violaxanthin. Ausgehend von Dtx wird Ddx durch die Diadinoxanthin-Deepoxidase (DDE) recycelt.
Bei diesem Zyklus tritt keine Verbindung mit einem Diepoxid auf, die Umwandlung von Dtx zu Ddx ist zudem sehr schnell.[6]
Diadinoxanthin-Deepoxidase (DDE)
Das Enzym DDE hat ein pH Optimum bei 5,5, zeigt aber auch in einem neutralen Milieu Aktivität.[6] Es benötigt als Cofaktor Ascorbat (AscH−), um das Epoxid zu reduzieren. Dabei wird wie bei der Violaxanthin-Deepoxidase (VDE) auch Wasser freigesetzt. Im Gegensatz zur VDE zeigt DDE einige Unterschiede: DDE benötigt weniger Ascorbat und dessen Aktivität wird durch geringere Konzentration an Monogalactosyldiacylglycerol stimuliert.[6]
Diatoxanthin-Epoxidase (DEP)
Für die Oxidation von Diatoxanthin zu Diadionoxanthin benötigt DEP dieselben Cofaktoren wie die Zeaxanthin-Epoxidase (ZE): NAD(P)H, FAD, Ferredoxin und Sauerstoff. Diese katalysierte Reaktion läuft bei einem pH-Optimum von 7,5 ab.[6] In der Dunkelheit und bei einem starken (lichtbetriebenen) pH-Gradienten an der Membran wird DEP vollständig inhibiert. Wahrscheinlich steht während der Dunkelheit nicht genügend NADPH zur Verfügung.[7]
Bedeutung
Für Kieselalgen ist der Diadinoxanthinzyklus der wichtigste Schutzmechanismus bei übermäßiger Anregung des Photosyntheseapparates. Im Gegensatz zum Xanthophyllzyklus laufen die Reaktionen viel schneller ab.
Lutein-Epoxidzyklus
In manchen Pflanzenarten dient der Lutein-Epoxidzyklus als Schutzmechanismus.[8][9]
Einzelnachweise
- ↑ a b c Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie. Spektrum Akademischer Verlag GmbH, 4. Auflage 2008; ISBN 978-3-8274-1961-3; S. 109–110.
- ↑ a b Szabó, I. et al. (2005): Light and oxygenic photosynthesis: energy dissipation as a protection mechanism against photo-oxidation. In: EMBO Rep. 6(7); 629–634; PMID 15995679; PDF (freier Volltextzugriff, engl.)
- ↑ Hieber, AD. et al. (2000): Plant lipocalins: violaxanthin de-epoxidase and zeaxanthin epoxidase. In: Biochim Biophys Acta 1482(1–2); 84–91; PMID 11058750; doi:10.1016/S0167-4838(00)00141-2.
- ↑ a b Jahns, P. et al. (2009): Mechanism and regulation of the violaxanthin cycle: the role of antenna proteins and membrane lipids. In: Biochim Biophys Acta 1787(1); 3–14; PMID 18976630; doi:10.1016/j.bbabio.2008.09.013.
- ↑ Caroline Bowsher, Martin Steer und Alyson Tobin: Plant Biochemistry. Garland Pub 2008; ISBN 978-0-8153-4121-5; S. 90.
- ↑ a b c d Wilhelm, C. et al. (2006): The regulation of carbon and nutrient assimilation in diatoms is significantly different from green algae. In: Protist. 157(2); 91–124; PMID 16621693; doi:10.1016/j.protis.2006.02.003.
- ↑ Grouneva, I. et al. (2009): The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. In: Biochim Biophys Acta 1787(7); 929–938; PMID 19232316; doi:10.1016/j.bbabio.2009.02.004.
- ↑ García-Plazaola, JI. et al. (2007): The lutein epoxide cycle in higher plants: its relationships to other xanthophyll cycles and possible functions. In: Functional Plant Biology 34(9); 759–773; doi:10.1071/FP07095.
- ↑ Bungard, RA. et al. (1999): Unusual carotenoid composition and a new type of xanthophyll cycle in plants. In: Proc Natl Acad Sci USA 96(3); 1135–1139; PMID 9927706; PDF (freier Volltextzugriff, engl.)
Literatur
- Jahns, P. et al. (2009): Mechanism and regulation of the violaxanthin cycle: the role of antenna proteins and membrane lipids. In: Biochim Biophys Acta 1787(1); 3–14; PMID 18976630; doi:10.1016/j.bbabio.2008.09.013
Siehe auch
Wikimedia Foundation.