- Beta-Amyloid
-
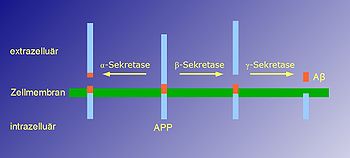
Beta-Amyloid Stäbchen-/Bändermodell von Aβ42; nach PDB 1IYT Masse/Länge Primärstruktur 40/42 Aminosäuren Präkursor Amyloid-Precursor-Protein Bezeichner Gen-Name(n) Abeta40, Abeta42 Externe IDs UniProt: P05067 Transporter-Klassifikation TCDB 1.C.50 Bezeichnung ABPP Vorkommen Homologie-Familie Beta-Amyloid Übergeordnetes Taxon Wirbeltiere β-Amyloid (genauer: Amyloid-beta 40 (Aβ40) und Amyloid-beta 42 (Aβ42)) heißen zwei Peptide, die durch Zerschneiden des Amyloid-Precursor-Proteins (APP) mithilfe der Enzyme Beta- und Gamma-Sekretase entstehen, wobei aber noch weitere Faktoren vorhanden sein müssen. Beta-Amyloidpeptide haben antimikrobielle Funktion.[1] Im normalen Stoffwechsel werden diese Peptide kontinuierlich erzeugt, lagern sich aber nicht ab. Aβ40 und Aβ42 gelten als neurotoxisch, beide sind als Ablagerungen in Gehirn und Blutgefäßen von Alzheimerkranken und Down-Syndrom-Patienten zu finden. Man nimmt daher an, dass eine Verhinderung der als senile Plaques bekannten Ablagerungen die Symptome dieser Krankheiten verbessern würde.[2][3]
Wissenschaftliche Studien haben ergeben, dass Amyloid-beta eine zentrale Funktion bei der Informationsverarbeitung im Gehirn hat. Eine bestimmte Menge des Proteins ist für die Übertragung von Informationen an Neuronen notwendig. Da die derzeitigen Forschungen zur Bekämpfung von Alzheimer hauptsächlich darauf ausgerichtet sind, Medikamente zu entwickeln, die Protein-Plaques abbauen, muss diese neue Erkenntnis miteinbezogen werden.[4][5]
Voraussetzungen für Aβ-Synthese
Weitere Faktoren für die Produktion von Aβ40/42 sind genetische Prädisposition, wie
- Veränderung des APP durch Mutation des APP-Gens (familiärer Alzheimer Typ 1)[2]
- Veränderungen am Gen, das für Apolipoprotein E codiert (familiärer Alzheimer Typ 2).[6][7]
- Veränderungen der gamma-Sekretase in ihren Präsenilin-Untereinheiten (Typ 3 und 4)[8]
- erhöhte Produktion des APP, wie beim Down-Syndrom
Diese seltenen Veränderungen am Genom können allein ausreichen, um Aβ in genügenden Mengen und damit auch Schäden entstehen zu lassen.
Weiterhin existieren ernährungsbedingte Risikofaktoren wie der Cholesterinspiegel: bei Cholesterinmangel bilden sich in vitro Beta-Amyloid-Peptide nicht. Damit zu tun hat möglicherweise, dass Aβ-Produktion ausschließlich in so genannten Lipid Rafts der Zellmembran stattfindet, und dass diese Gebilde vornehmlich aus Cholesterin bestehen.[9][10][11]
Es scheint allerdings weitere Risikofaktoren zu geben. Mehrere Arzneistoffe erhöhen die Aβ42-Produktion auf gefährliche Level in vitro und im Mausmodell. Verdächtigt werden spezifische Hemmer für die Cyclooxygenase 2 und gewisse Isoprenoide.[12]
Toxizität
Für den Mechanismus der Neurotoxizität der Peptide gibt es mehrere Erklärungsversuche. Zum einen könnten die Peptide Ionenkanäle in der Zellmembran der Neuronen bilden. Möglicherweise aber handelt es sich eher um kleine, aber zahlreiche Membrandefekte, die von Amyloiden verursacht werden und die für die Schädigungen verantwortlich sind.[13][14]
Einzelnachweise
- ↑ Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, et al. (2010): The Alzheimer's Disease-Associated Amyloid β-Protein Is an Antimicrobial Peptide. PLoS ONE 5(3): e9505. doi:10.1371/journal.pone.0009505
- ↑ a b UniProt P06067
- ↑ Masters CL, Simms G, Weinman NA, Multhaup G, McDonald BL, Beyreuther K: Amyloid plaque core protein in Alzheimer disease and Down syndrome. In: Proc. Natl. Acad. Sci. U.S.A.. 82, Nr. 12, Juni 1985, S. 4245–9. PMID 3159021. Volltext bei PMC: 397973.
- ↑ ScienceDaily: Alzheimer's: Destructive Amyloid-Beta Protein May Also Be Essential for Normal Brain Function (gesehen am 25. November 2009)
- ↑ Abramov et al.: Amyloid-β as a positive endogenous regulator of release probability at hippocampal synapses Nature Neuroscience, 2009; doi:10.1038/nn.2433
- ↑ UniProt P02649
- ↑ Strittmatter WJ, Weisgraber KH, Huang DY, et al: Binding of human apolipoprotein E to synthetic amyloid beta peptide: isoform-specific effects and implications for late-onset Alzheimer disease. In: Proc. Natl. Acad. Sci. U.S.A.. 90, Nr. 17, September 1993, S. 8098–102. PMID 8367470. Volltext bei PMC: 47295.
- ↑ UniProt P49768, UniProt P49810
- ↑ Simons M, Keller P, De Strooper B, Beyreuther K, Dotti CG, Simons K: Cholesterol depletion inhibits the generation of beta-amyloid in hippocampal neurons. In: Proc. Natl. Acad. Sci. U.S.A.. 95, Nr. 11, Mai 1998, S. 6460–4. PMID 9600988. Volltext bei PMC: 27798.
- ↑ Cordy JM, Hussain I, Dingwall C, Hooper NM, Turner AJ: Exclusively targeting beta-secretase to lipid rafts by GPI-anchor addition up-regulates beta-site processing of the amyloid precursor protein. In: Proc. Natl. Acad. Sci. U.S.A.. 100, Nr. 20, September 2003, S. 11735–40. doi:10.1073/pnas.1635130100. PMID 14504402. Volltext bei PMC: 208827.
- ↑ Fassbender K, Simons M, Bergmann C, et al: Simvastatin strongly reduces levels of Alzheimer's disease beta -amyloid peptides Abeta 42 and Abeta 40 in vitro and in vivo. In: Proc. Natl. Acad. Sci. U.S.A.. 98, Nr. 10, Mai 2001, S. 5856–61. doi:10.1073/pnas.081620098. PMID 11296263. Volltext bei PMC: 33303.
- ↑ Kukar T, Murphy MP, Eriksen JL, et al: Diverse compounds mimic Alzheimer disease-causing mutations by augmenting Abeta42 production. In: Nat. Med.. 11, Nr. 5, Mai 2005, S. 545–50. doi:10.1038/nm1235. PMID 15834426.
- ↑ TCDB: 1.C.50
- ↑ Green JD, Kreplak L, Goldsbury C, et al: Atomic force microscopy reveals defects within mica supported lipid bilayers induced by the amyloidogenic human amylin peptide. In: J. Mol. Biol.. 342, Nr. 3, September 2004, S. 877–87. doi:10.1016/j.jmb.2004.07.052. PMID 15342243.
Kategorien:- Peptid
- Porenbildendes Protein
Wikimedia Foundation.