- Binäre Verbindung
-
Als chemische Verbindung bezeichnet man einen chemischen Stoff, der aus zwei oder mehr verschiedenen chemischen Elementen besteht, welche – im Gegensatz zu Gemischen – in einem festen Atom- und daher auch Massenverhältnis zueinander stehen. Charakteristisch für jede chemische Verbindung ist ihre eindeutige Chemische Struktur. Oft nicht eindeutig ist die Summenformel, mit der man unter Verwendung der molaren Masse beispielsweise die Menge an Produkten einer chemischen Reaktion errechnen kann (in der Stöchiometrie, mit Hilfe eines Reaktionsschemas). Isomere chemische Verbindungen besitzen dieselbe Summenformel, aber eine unterschiedliche Molekülstruktur.
Inhaltsverzeichnis
Arten von chemischen Verbindungen
Grob unterscheidet man bei den über 17 Millionen bekannten chemischen Verbindungen ionische, d. h. salzartige Verbindungen sowie Komplexe, metallische sowie molekulare Verbindungen. Auch die Unterteilung anorganisch/organisch ist grundlegend, wobei als „organisch“ die Kohlenstoff-Verbindungen bezeichnet werden (mit wenigen Ausnahmen). Grundsätzlich gibt es also vier Arten von chemischen Verbindungen zwischen den Atomen der Elemente:
Molekulare Verbindungen
- Molekulare Verbindungen entstehen aus Nichtmetall und Nichtmetall – sie sind Nichtleiter (Isolatoren) mit zumeist relativ niedrigem Siedepunkt (diamantartige oder kunststoffartige Verbindungen mit Riesenmolekülen ausgenommen). Beispiele für molekulare Verbindungen sind neben Wasser auch Methangas, Zucker, Kohlensäure, Polyethylen usw.
Ionische Verbindungen
- Ionische Verbindungen (Salze) bestehen aus Kationen und Anionen. Sie sind oft salzartig: spröde, von hohem Schmelzpunkt und elektrisch leitfähig nur in Schmelze oder Lösung. Beispiele für Ionenverbindungen sind Eisen(III)-oxid (dem Rost ähnlich), Pyrit (Eisensulfid) und Natriumchlorid (Kochsalz).
Intermetallische Verbindung
Intermetallische Verbindung entstehen aus Metall und Metall – sie sind:
- elektrisch leitfähig
- gut verformbar
- glänzend und
- gute Wärmeleiter
- bei Zimmertemperatur fest (außer Quecksilber)
Komplexe
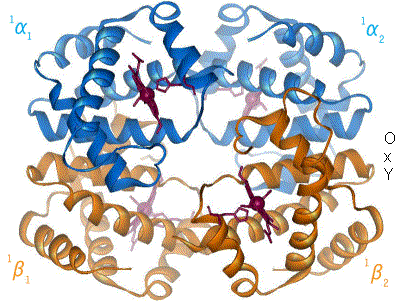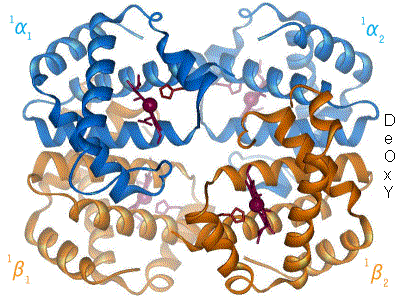 Der Blutfarbstoff Hämoglobin – ein Eisenkomplex im Blut, dessen Struktur sich mit der Aufnahme (Oxygenation) bzw. der Abgabe von Sauerstoff (Desoxygenation) ändert. (Komplexbildungsreaktion)
Der Blutfarbstoff Hämoglobin – ein Eisenkomplex im Blut, dessen Struktur sich mit der Aufnahme (Oxygenation) bzw. der Abgabe von Sauerstoff (Desoxygenation) ändert. (Komplexbildungsreaktion)- Verbindungen höherer Ordnung (Komplexe) entstehen bei einer Komplexbildungsreaktion zumeist aus Buntmetallkation und Molekülen mit freien Elektronenpaaren (Liganden). Sie sind oft auffallend farbig.
Beispiele: Der rote Blutfarbstoff Hämoglobin aus Eisen-II-Ionen und Eiweißmolekülen und der tiefblaue Kupfertetrammin-Komplex aus Kupfer-II-Ionen und Ammoniak).
Binäre, ternäre und quaternäre Verbindungen
Chemischen Verbindungen lassen sich über die Anzahl der beteiligten chemischen Elemente einteilen. Binäre Verbindungen setzen sich aus zwei verschiedenen Elementen zusammen und haben die allgemeine Formel AxBy. Chlorwasserstoff (HCl), Natriumfluorid (NaF) und Wasser (H2O) setzen sich jeweils aus zwei Elementen zusammen und sind damit alle binäre Verbindungen. Die Verbindungen können molekulare, ionische (Salze) oder intermetallische Verbindungen sein. Analog dazu setzen sich ternäre Verbindungen aus drei verschiedenen Elementen zusammen, wie z. B. Natriumcarbonat (Na2CO3), das sich aus Natrium, Kohlenstoff und Sauerstoff zusammensetzt. Eine quaternäre Verbindung ist beispielsweise Kaliumhydrogencarbonat (KHCO3).
Der Begriff primäre Verbindung macht hingegen keinen Sinn, da definitionsgemäß chemische Verbindungen aus mindestens zwei Elementen zusammengesetzt sein müssen. Unterschiedliche Stoffe aus nur einem Element werden Modifikationen genannt. Gelegentlich wird auch der Begriff Elementverbindung verwendet.
Siehe auch
- Organische Verbindung
- Chemikalienliste
- Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien
Weblinks
Wikimedia Foundation.



USGOV.jpg)