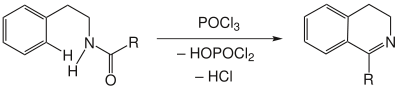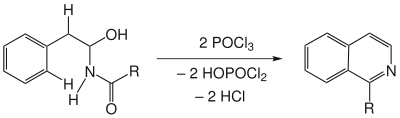- Bischler-Napieralski-Reaktion
-
Die Bischler-Napieralski-Reaktion ist eine Reaktion aus dem Bereich der Organischen Chemie, welche der Herstellung von Heterocyclen dient. Sie ist nach ihren Entdeckern, den Chemikern August Bischler und Bernard Napieralski (ehemals tätig an der an der Universität Zürich) benannt und beschreibt die Cyclisierung von Amiden in Gegenwart von Lewis-Säuren. Diese Reaktion wird häufiger in der Totalsynthese von Alkaloiden benutzt.
Inhaltsverzeichnis
Reaktionsgleichung
Amide werden durch Einwirkung von POCl3 unter Wasserabspaltung cyclisiert.[1] [2] [3] [4] Allerdings ist diese Wasserabspaltung rein formal, tatsächlich entstehen neben dem gewünschten Produkt HOPOCl2 und HCl.[5]
Sind die Arylgruppen weniger nucleophil, müssen drastischere Reaktionsbedingungen angewandt werden. Indole reagieren bereits bei Erwärmung während bei Benzol höhere Temperaturen benötigt werden.
POCl3 ist bei chemischen Reaktionen das häufigste Entwässerungsmittel. PCl5, Polyphosphorsäure und ZnCl2 wurden ebenfalls erfolgreich getestet.Mechanismus
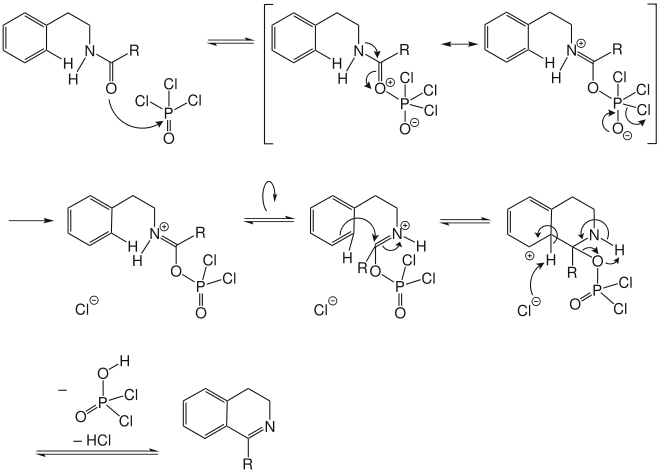
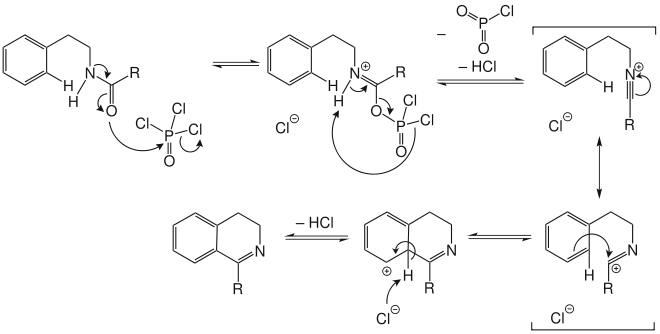
Für den Mechanismus der Bischler-Napieralski-Reaktion gibt es in der Literatur zwei verschiedene Möglichkeiten. Welcher im Spezialfall abläuft, hängt unter anderem von den Reaktionsbedingungen ab. Der Unterschied zwischen den beiden Möglichkeiten liegt im Zeitpunkt der Eliminierung des Carbonyl-Sauerstoff-Atoms. Bei Mechanismus I[5] findet sie nach dem Ringschluss mit Bildung des Imins, bei Mechanismus II[6] findet sie unter Bildung eines Nitrilium-Ions vor dem Ringschluss statt.
Mechanismus I:
Mechanismus II:
Variante
Enthält die Ausgangssubstanz in α-Stellung zur Aminogruppe eine Hydroxylgruppe, so tritt eine weitere formale Wasserabspaltung ein und es bildet sich ein Isochinolin-Derivat.
Die Bischler-Napieralski-Reaktion ist für die Totalsynthese gewisser Alkaloide (z. B. Papaverin oder Reserpin) von Bedeutung.
Siehe auch
Einzelnachweise
- ↑ August Bischler, Bernard Napieralski: Zur Kenntniss einer neuen Isochinolinsynthese. In: Berichte der Deutschen Chemischen Gesellschaft. 26, Nr. 2, 1893, S. 1903. doi:10.1002/cber.189302602143.
- ↑ Whaley, W.M.; Govindachari, T.R. Org. React. 1951, 6, 74.
- ↑ Bergstrom, F. W. Chem. Rev. 1944, 35, 218.
- ↑ Gábor Fodor, J. Gal, B. A. Phillips: The Mechanism of the Bischler-Napieralski Reaction. In: Angewandte Chemie International Edition in English. 11, Nr. 10, 1972, S. 919–920. doi:10.1002/anie.197209191.
- ↑ a b László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
- ↑ G. Fodor, S. Nagubandi: Correlation of the von Braun, Ritter, Bischler-Napieralski, Beckmann and Schmidt reactions via nitrilium salt intermediates , in: Tetrahedron 1980, 36, 1279 doi:10.1016/0040-4020(80)85039-3.
Quellen
- Hans Rudolf Christen: Grundlagen der organischen Chemie, Verlag Sauerländer · Diesterweg· Salle (1977), S. 658
Wikimedia Foundation.