- Bevasiranib
-
Strukturformel 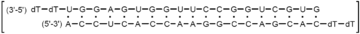
Allgemeines Freiname Bevasiranib Andere Namen - Bevasiranibum
- Cand-5
- Duplex aus Thymidylyl-(3'→5')-thymidylyl-(3'→5')- uridylyl-(3'→5')-guanylyl-(3'→5')-guanylyl-(3'→5')- adenylyl-(3'→5')-guanylyl-(3'→5')-uridylyl-(3'→5')- guanylyl-(3'→5')-guanylyl-(3'→5')-uridylyl-(3'→5')- uridylyl-(3'→5')-cytidylyl-(3'→5')-cytidylyl-(3'→5')- guanylyl-(3'→5')-guanylyl-(3'→5')-uridylyl-(3'→5')- cytidylyl-(3'→5')-guanylyl-(3'→5')-uridylyl-(3'→5')- guanosin und Thymidylyl-(3'→5')-thymidylyl-(3'→5')- cytidylyl-(3'→5')-adenylyl-(3'→5')-cytidylyl-(3'→5')- guanylyl-(3'→5')-adenylyl-(3'→5')-cytidylyl-(3'→5')- cytidylyl-(3'→5')-guanylyl-(3'→5')-guanylyl-(3'→5')- adenylyl-(3'→5')-adenylyl-(3'→5')-cytidylyl-(3'→5')- cytidylyl-(3'→5')-adenylyl-(3'→5')-cytidylyl-(3'→5')- uridylyl-(3'→5')-cytidylyl-(3'→5')-cytidylyl-(3'→5')- adenosin[1]
Summenformel - C401H503N153O290P40 (Bevasiranib)
- C401H463N153Na40O290P40 (Bevasiranib-Natrium)[1]
CAS-Nummer 959961-96-7 Eigenschaften Molare Masse Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bevasiranib ist ein in der klinischen Entwicklungsphase befindlicher biologischer Wirkstoff. Er ist chemisch eine sogenannte siRNA und einer der ersten an Patienten getesteten Wirkstoffe dieser Stoffgruppe. Bevasiranib entfaltet seine Wirkung über eine Stilllegung des Gens für den Vascular Endothelial Growth Factor (VEGF) durch RNA-Interferenz. Er soll potenziell als Arzneistoff in der Behandlung der altersbedingten Makuladegeneration eingesetzt werden. Bevasiranib wurde von dem Pharmaunternehmen OPKO entwickelt.
Inhaltsverzeichnis
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Bevasiranib unterscheidet sich als eine siRNA von konventionellen niedermolekularen und proteinischen Wirkstoffen. Es macht sich den zelleigenen Mechanismus der RNA-Interferenz zunutze und hemmt die Aktivierung des VEGF-Gens. Als Folge wird weniger VEGF-Protein am Verabreichungsort gebildet. Im Gegensatz zu anderen VEGF-Inhibitoren, wie Bevacizumab und Ranibizumab, blockiert Bevasiranib nicht direkt das Wachstumsfaktor-Protein. Bevasiranib hat somit keine sofortige Wirkung, da erst bereits vorhandenes VEGF abgebaut werden muss.
Im Tierexperiment hemmt Bevasiranib die für die altersbedingte Makuladegeneration verantwortliche Neovaskularisation der Netz- und Aderhaut des Auges.[3]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Nach einer intravitrealen Injektion in den Glaskörper des Auges verteilt sich Bevasiranib im Tierexperiment in die Iris, die Sklera und insbesondere in die Netzhaut. Die höchste Konzentration wird in den Zielgeweben nach 24 bis 72 Stunden erreicht. Die Halbwertzeit im Auge liegt zwischen 50 und 80 Stunden.[4]
Geschichte
Bevasiranib war die erste siRNA, die an Patienten in klinischen Studien der Phase III getestet wurde. Die erste Phase-III-Studie, die sogenannte COBALT-Studie (Combining-Bevasiranib-And-Lucentis-Therapy-Studie) wurde abgebrochen,[5] nachdem klar wurde, dass das Studienziel nicht erreicht werden kann. Weitere klinische Studien der Phase III mit anderen Dosierungsschemata befinden sich in der Vorbereitung.
Einzelnachweise
- ↑ a b c World Health Organisation: International Nonproprietary Names for Pharmaceutical Substances (INN) - Recommended International Nonproprietary Names: List 61. In: WHO Drug Information. 23, Nr. 1, 2009.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Reich SJ, Fosnot J, Kuroki A, et al.: Small interfering RNA (siRNA) targeting VEGF effectively inhibits ocular neovascularization in a mouse model. In: Mol. Vis.. 9, Mai 2003, S. 210–216. PMID 12789138.
- ↑ Dejneka NS, Wan S, Bond OS, Kornbrust DJ, Reich SJ: Ocular biodistribution of bevasiranib following a single intravitreal injection to rabbit eyes. In: Mol. Vis.. 14, 2008, S. 997–1005. PMID 18523657. Volltext bei PMC: 2405815.
- ↑ ClinicalTrials.gov: Safety & Efficacy Study Evaluating the Combination of Bevasiranib & Lucentis Therapy in Wet AMD (COBALT). Abgerufen am 7. November 2010.

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
