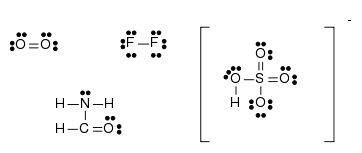
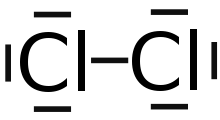- Elektronenformel
-
 Darstellung von Chlorwasserstoff mittels Elektronenformel
Darstellung von Chlorwasserstoff mittels Elektronenformel
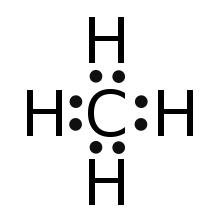 Darstellung von Methan als Elektronenformel
Darstellung von Methan als Elektronenformel
Die Elektronenformel – auch Lewis-Formel oder Lewis-Struktur (nach Gilbert Newton Lewis) ist eine Strukturformel zur Darstellung von Atomen und Molekülen, die die Struktur der Moleküle aufzeigt. Die Elektronenformel ist eine Symbolschreibweise, mit der der Aufbau eines Moleküls unter Angabe der einzelnen Atome und Valenzelektronen beschrieben wird.[1]
Inhaltsverzeichnis
Aufbau
In der Elektronenformel steht das Elementsymbol für den Atomrumpf, also für den Atomkern mit den inneren Elektronenschalen, während die ein bis acht gebundenen und ungebundenen Valenzelektronen in der äußersten Elektronenschale des Atoms durch Punkte dargestellt werden. Die Elektronen werden auf möglichst vier Positionen um das Atomsymbol herum verteilt.
Die knappe Darstellung in der Elektronenformel erfüllt ihren Zweck ausreichend, da für chemische Reaktionen bzw. für chemische Bindungen nur die Außenelektronen der Atome maßgebend sind. Die Elektronenformel stellt lediglich die Bindungselektronen dar, als Teil der Elektronenhüllen beider Atome, die an einer chemischen Bindung beteiligt sind.
Mittels der Elektronenformel lassen sich Atome zu Molekülen kombinieren. Bei bekannter atomarer Zusammensetzung von kleinen Molekülen lässt sich der molekulare Aufbau einer Verbindung vorhersagen.
Abgrenzung zur Valenzstrichformel
 Darstellung von Chlor mit der Elektronenformel
Darstellung von Chlor mit der Elektronenformel
Im Gegensatz zur Valenzstrichformel werden die Valenzelektronen der Nichtmetallatome einzeln bildlich dargestellt und nicht als Paar zu sogenannten Valenzstrichen zusammengenommen, die für ein Bindungselektronenpaar eines Molekülorbitals stehen.
Die Abgrenzung zwischen Valenzstrichformel und Elektronenformel ist nicht einheitlich. Stellenweise wird der Begriff „Elektronenformel“ sogar synonym für „Valenzstrichformel“, auch „Elektronenformel nach Lewis“ genannt, verwendet.
Als Mischform existiert auch die Schreibweise, dass ein Strich jeweils zwei Außenelektronen (freies Elektronenpaar, nichtbindendes Elektronenpaar) ersetzt, die dasselbe Orbital besetzen. Punkte hingegen symbolisieren einzelne Elektronen, was in der Valenzstrichschreibweise nicht möglich ist.
Einzelnachweis
- ↑ Eintrag: Lewis formula (electron dot or Lewis structure). In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.L03513 (Version: 2.1.3).
Literatur
- Gilbert Newton Lewis: Valence and the structure of atoms and molecules. 1923, ISBN 0486615553
- Gilbert Newton Lewis: The Atom and the Molecule. In: J. Am. Chem. Soc. 38. 1916, 762–785. doi:10.1021/ja02261a002
Wikimedia Foundation.