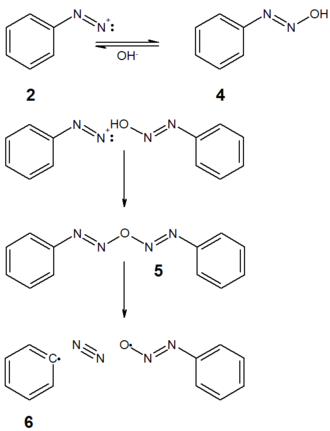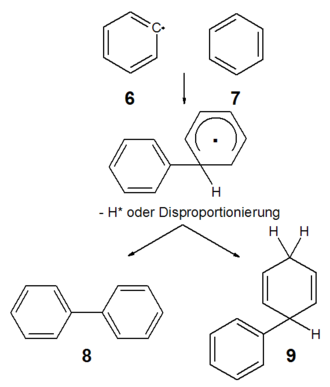- Gomberg-Bachmann-Reaktion
-
Die Gomberg-Bachmann-Reaktion ist eine 1924 entwickelte Reaktion zur Synthese von Diarylen aus Diazoniumsalzen. Benannt wurde sie nach dem ukrainisch-US-amerikanischen Chemiker Moses Gomberg und dem US-amerikanischen Chemiker Werner Emmanuel Bachmann. Nach Gomberg-Bachmann werden symmetrische und nicht symmetrische Biphenyle hergestellt.
Inhaltsverzeichnis
Bruttoreaktion
Mechanismus
Die Gomberg-Bachmann-Reaktion ist eine radikalische Substitution an einem Aromaten durch ein Aryl-Radikal unter Bildung von Biphenylen.[1][2][3]
Die Arylkomponente 1 (hier Benzol) reagiert in einer Kupplungsreaktion mit dem Diazoniumsalz 2 zum Biphenyl 3. Intermediär wird ein Aryl-Radikal gebildet, das die Arylkomponente 1 radikalisch substituiert. Mit der Gomberg-Bachmann-Reaktion sind viele Bisaryle zugänglich; aufgrund von Nebenreaktionen des Diazonium-Salzes meist in schlechter Ausbeute (<40%).
Das Diazoniumsalz 2 bildet in wässriger alkalischer Lösung in einer Gleichgewichtsreaktion ein Diazohydroxid 4, das mit einem weiteren Diazoniumsalz 2 unter Deprotonierung zum Anhydrid 5 reagiert. Dieses wird als unpolares Molekül in die organische Phase (dem zu phenylierenden Aromaten) extrahiert und zerfällt homolytisch in Stickstoff, in ein [Aryldiazenyl]oxidanyl-Radikal und in ein Arylradikal 6.[4] Den Beweis für die Existenz des Diazo-Anhydrids 5 erbrachte Rüchardt durch Kreuzungsexperimente.[5] Mit Phasentransfer-Katalysatoren werden höhere Ausbeuten erreicht.[6]
Das reaktive Arylradikal 6 greift einen Aromaten 7 unter Bildung eines Phenylcyclohexadienyl-Radikals 8 an. Dieses stabilisiert sich durch Abstraktion eines Wasserstoffradikals Biphenyl, 9) oder durch Disproportionierung zu Biphenyl und Cyclohexa-2,5-dien-1-ylbenzol 10 (Additions-Eliminierungs-Mechanismus).[7]
Selektivität
Gemäß der allgemeinen Regel, dass die Selektivität mit zunehmender Reaktivität abnimmt, sind die hoch reaktiven Arylradikale wenig selektiv. Deshalb wird als Aromat meist Benzol eingesetzt. Für Toluol ergibt sich bei der radikalischen Phenylierung ein Produktverhältnis ko : km : kp = 4,36 : 1,34 : 1,00.[8]
Beispiel
4-Brombiphenyl kann durch Diazotierung von 4-Bromanilin und der folgenden Umsetzung mit Benzol in alkalischer Lösung hergestellt werden.[9]
Varianten
Die intramolekulare Variante der Gomberg-Bachmann Reaktion ist als Pschorr-Reaktion bekannt.
Siehe auch
- Graebe-Ullmann Synthese
- Meerwein Arylierung
- Sandmeyer-Reaktion
- Ullmann-Reaktion
Einzelnachweise
- ↑ M. Gomberg, W. E. Bachmann: THE SYNTHESIS OF BIARYL COMPOUNDS BY MEANS OF THE DIAZO REACTION. In: J. Am. Chem. Soc.. Bd. 42, 1924.(Quelle)
- ↑ M. B. Smith, J. March: March's Advanced Organic Chemistry. Wiley, 2001, ISBN 0-471-58589-0.
- ↑ R. Bolton, G. Williams: Review. In: Chem. Soc. Rev.. Bd. 15, 1986.
- ↑ Jan Bülle, Aloys Hüttermann: Das Basiswissen der organischen Chemie. Wiley-VCH, 2008, ISBN 978-3527308477.
- ↑ Ch. Rüchardt, E. Merz.: .. In: Tetrahedron Lett.. Bd, 1964.
- ↑ Beadle, J.R et al.: .. In: J. Org. Chem.. Bd. 49, 1984.
- ↑ E. Breitmaier, G. Jung,: 'Organische Chemie. Thieme-Verlag, 2009, ISBN 978-3135415048.
- ↑ S. Hauptmann: 'Reaktion und Mechanismus in der organischen Chemie. Teubner Verlag, 1991, ISBN 978-3519035152.
- ↑ M. Gomberg, W. E. Bachmann: p-Bromobiphenyl. In: OrgSynth.. Bd. 1, Nr. 113, 1941.(Quelle)
Wikimedia Foundation.