- Knorr-Pyrrolsynthese
-
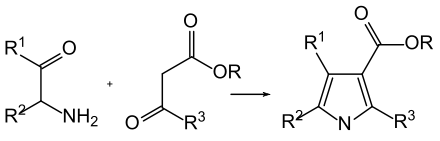
Die Knorr-Pyrrolsynthese ist eine verbreitete chemische Reaktion zu Synthese von substituierten Pyrrolen.[1][2][3] Sie ist nach ihrem Entdecker, dem deutschen Chemiker Ludwig Knorr, benannt und gehört zu den Namensreaktionen. Bei dieser Reaktion werden α-Amino-ketone und β-Ketoester zu Pyrrolen umgesetzt.[4] Die Reaktion wird in Anwesenheit von Zink durchgeführt und findet aufgrund der hohen Reaktivität der α-Amino-ketone bei Raumtemperatur statt. Da α-Amino-ketone nicht stabil sind und selber eine Kondensationsreaktion eingehen, müssen sie in situ, zum Beispiel aus den Oximen, freigesetzt werden.[5][6] Die erhaltenen Heterocyclen werden auch als Knorr-Pyrrole bezeichnet.
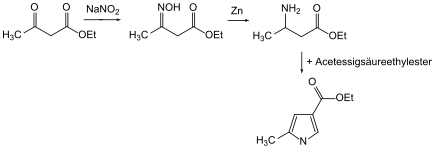
In der ursprünglichen Knorr-Pyrrolsynthese wurden zwei Äquivalente Acetessigsäureethylester umgesetzt. Dabei wurde ein Aquivalent durch Eisessig und Natriumnitrit zum 2-Oximinoacetessigsäureester umgesetzt. Zinkstaub reduziert nun das Oxim zum aktiven Amin und die Kondensationsreaktion kann einsetzen.
Es existieren zahlreiche modernere Varianten zu dem klassischen Verfahren von Knorr. Von Levi und Zanetti existiert eine Erweiterung der Knorr-Pyrrolsynthese auf Acetylaceton (2,4-Pentandion), welches mit dem Oxim zu Pyrrolen umgesetzt wird.[7]
Einzelnachweise
- ↑ Knorr, L. Ber. 1884, 17, 1635.
- ↑ Knorr, L. Ann. 1886, 236, 290.
- ↑ Knorr, L.; Lange, H. Ber. 1902, 35, 2998.
- ↑ Corwin, A. H. Heterocyclic Compounds 1950, 1, 287. (Review)
- ↑ Fischer, H. Organic Syntheses, Coll. Vol. 2, p.202 (1943); Vol. 15, p.17 (1935). [1]
- ↑ Fischer, H. Organic Syntheses, Coll. Vol. 3, p.513 (1955); Vol. 21, p.67 (1941). [2]
- ↑ Zanetti, C.U.; Levi, E. Gazz. Chim. Ital. 1894, 24, I, 546.
Wikimedia Foundation.