- Reissert-Indol-Synthese
-
Die Indolsynthese nach Reissert[1] ist eine Namensreaktion der organischen Chemie, die ebenso wie bspw. die Fischersche Indolsynthese über mehrere Stufen verläuft.[2]
Reaktionsmechanismus
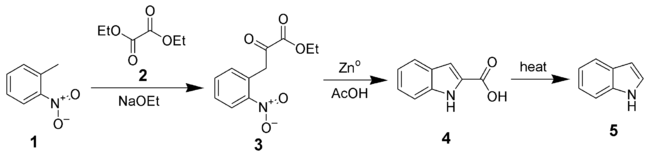
In Nitrotoluolen (1) ist die Methylfunktion durch den elektropositiven Charakter der Nitrofunktion stark azidifiziert. Aus diesem Grunde kann in Anwesenheit starker Basen (bspw. eines Alkoholates, Vgl. Natriumethanolat) die Methylgruppe deprotoniert und so das Nitrotoluol in ein Nucleophil verwandelt werden. Dieser Effekt kann über das Vinylogie-Prinzip erklärt werden, denn auch aliphatische Nitroverbindungen sind in deprotonierter Form als starke Nucleophile[3] bekannt (Vgl. Henry-Reaktion). Zur Durchführung der Reissert-Indol-Synthese ist vor allem die Umsetzung mit Glyoxalsäureestern (2) zu erwähnen, bei der 3-(2-Nitrophenyl)-Derivate der Brenztraubensäure (3) erzeugt werden. In einem weiteren Schritt wird die Nitrofunktion reduziert und so eine Zyklisierung (mit nachgestellter Aromatisierung) zwischen der aus der Nitrofunktion entstandenen Aminofunktion und der im ersten Schritt erzeugten Ketofunktion unter Abspaltung von Wasser in einer Tandem-Reaktion erreicht (als Reduktionsmittel dient dabei bspw. Zinkpulver in Eisessig). Das so erzeugte Indol-2-carbonsäure-Derivat (4) kann unter Hitzeeinwirkung und Abspaltung von Kohlenstoffdioxid decarboxyliert werden (unter Bildung von (5)); dieser letzte Schritt verläuft vollkommen analog zur klassischen Fischerschen Indolsynthese.
Einzelnachweise
- ↑ Reissert, A. Ber. 1897, 30, 1030−1053.
- ↑ Jie Jack Li "Name Reactions in Heterocyclic Chemistry" 1st Edition, ISBN 0-471-30215-5, pp154
- ↑ http://www.cup.lmu.de/oc/mayr/ReactScalesAll.pdf
Wikimedia Foundation.