- Chromate
-
Chromate 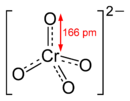
Chromat-Anion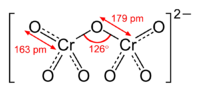
Dichromat-Anion
Kaliumchromat-Kristalle
Kaliumdichromat-KristalleChromate sind Salze der Chromsäure (H2CrO4). Das Chromat-Anion CrO42− hat eine gelbe Farbe und eine tetraedrische Struktur. Das Dichromat-Anion (Cr2O72−) hat eine orange Farbe und ist aus zwei verzerrten, eckenverknüpften Tetraedern aufgebaut. Zwischen Chromaten und Dichromaten besteht in wässrigen Lösungen ein pH-abhängiges chemisches Gleichgewicht, das dem Prinzip vom kleinsten Zwang gehorcht:
Unter sehr sauren Bedingungen und konzentrierten Lösungen bilden sich in einer analogen Reaktion die eher rötlichen Trichromate (Cr3O102−), Tetrachromate (Cr4O132−) und tiefrote Polychromate (CrnO3n+12−).
Alle Chromate sind – besonders unter sauren Bedingungen – starke Oxidationsmittel.
Verwendung und Sicherheitshinweise
Chromate finden teilweise Verwendung als Korrosionsschutzmittel (Pigmente, siehe auch Rostumwandler).
Viele Chromate haben eine intensive Färbung, deshalb werden (oder wurden) sie als farbgebender Bestandteil in Malerfarbe verwendet, beispielsweise „Chromgelb“ (PbCrO4).
Chromate finden Verwendung in der analytischen Chemie, wo sie als Fällungsreagenzien verwendet werden.In der organischen Chemie benutzt man Chromate beispielsweise für die Oxidation von Alkoholen. Bekannt sind hierbei die Jones-Reagenz aus Chrom(VI)-Oxid, konz. Schwefelsäure und Aceton (Jones-Oxidation) zur Herstellung von Carbonsäuren und die Collins-Reagenz, mit welcher man die Oxidation des Alkohols auf der Stufe des Aldehyds anhalten kann.
Alle Chromate und andere Chrom(VI)-verbindungen (mit Ausnahme des wasserunlöslichen Bariumchromats) sind stark giftig, wassergefährdend und krebserzeugend; Beispiele sind etwa Ammoniumdichromat, Kaliumdichromat, Natriumchromat, Lithiumchromat, Zinkchromat, Strontiumchromat und Chrom(III)-chromat.
Siehe auch
Weblinks
- Prof. Blumes Bildungsserver für Chemie: Das Chromat-Dichromat-Gleichgewicht
Wikimedia Foundation.


