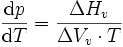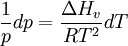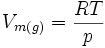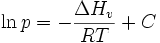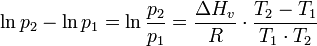- Clausius-Clapeyron
-
Die Clausius-Clapeyron-Gleichung wurde 1834 von Benoit Clapeyron entwickelt und später von Rudolf Clausius aus den Theorien der Thermodynamik abgeleitet. Sie ist eine Spezialform der Clapeyron-Gleichung.
Über sie lässt sich der Verlauf der Phasengrenzlinie eines Phasendiagramms zwischen der flüssigen und der gasförmigen Phase eines Stoffes, der Siedepunktskurve, errechnen. Die thermodynamisch korrekte Version der Gleichung ist
Allerdings bezeichnet man im Regelfall die näherungsweise gültige Gleichung:
als Clausius-Clapeyron-Gleichung. Hier wurde in guter Näherung
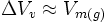 gesetzt, da das Molvolumen eines Gases viel größer als das einer Flüssigkeit ist, und es wurde ein ideales Gas angenommen, für das gilt:
gesetzt, da das Molvolumen eines Gases viel größer als das einer Flüssigkeit ist, und es wurde ein ideales Gas angenommen, für das gilt:Anwendung auf ideale Gase
Betrachtet man über einen kleinen Temperaturbereich die Verdampfungsenthalpie eines Stoffes als konstant, so hängen der Dampfdruck p und die Temperatur T wie folgt zusammen:
Um nun den Sättigungsdampfdruck p1 einer Flüssigkeit bei einer Temperatur T1 mit dem Sättigungsdampfdruck p2 der gleichen Flüssigkeit bei einer Temperatur T2 zu vergleichen, verwendet man die Clausius-Clapeyron-Gleichung in folgender Form:
mit
- T1 = Temperatur (in Kelvin) und P1 = Dampfdruck des Ausgangszustands
- T2 und P2 Druck und Temperatur des zu vergleichenden Zustands
- ΔHv ist die molare Verdampfungswärme
- R ist die Universelle Gaskonstante (8.314 J mol-1K-1)
Literatur
- M.K. Yau & R.R. Rogers, Short Course in Cloud Physics, Third Edition, publiziert von Butterworth-Heinemann, Jan. 1989, 304 Seiten. ISBN 0750632151
Wikimedia Foundation.