- Corrin-Ring
-
Strukturformel 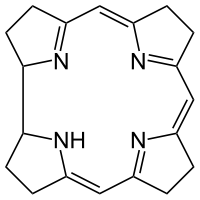
Allgemeines Name Corrin Andere Namen CRN
Summenformel C19H22N4 CAS-Nummer 262-76-0 PubChem 6438343 Kurzbeschreibung heterocyclisches Ringsystem Eigenschaften Molare Masse 306,41 g·mol−1 Aggregatzustand fest
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Corrin ist ein heterocyclisches Ringsystem, verwandt mit dem Porphyrin-Ring im Hämoglobin. Er besteht aus vier reduzierten Pyrrol-Untereinheiten (Tetrapyrrol), die auf zwei gegenüberliegenden Seiten über je eine −C(CH3)= Methin-Brücke, auf einer Seite über eine −CH= Methin-Brücke und auf der letzten Seite direkt verbunden sind. Verglichen mit Porphyrin fehlt somit eine Methin-Brücke zwischen zwei Pyrrolen.
Die Corrin-Ringstruktur ist die zentrale Komponente im Cobalt-haltigen Vitamin B12 (Cyanocobalamin). Sie hat ähnliche Eigenschaften wie Porphyrin, ist jedoch
- beweglicher,
- nicht so eben wie Porphyrin und
- verfügt aufgrund der einen fehlenden Methin-Brücke nicht über aromatische Eigenschaften.
Inhaltsverzeichnis
Corrinoide
Verbindungen, die Corrin als Grundgerüst enthalten, werden Corrinoide genannt. Fast alle natürlichen, metallhaltigen Corrinoide enthalten ein zentrales Cobaltatom, wohingegen die verwandten Porphyrine verschiedene Metalle enthalten können (wie Platin, Nickel, Cobalt, Kupfer, Eisen, Zink und Magnesium). Aus phototrophen Bakterien wurden metallfreie Corrinoide isoliert. Corrinoide werden nur von Mikroorganismen produziert.
Biosynthese
Der Genus Propionibakterium synthetisiert verschiedene Corrinoide ausgehend von der Aminosäure Alanin. Diese wird zum Porphobilinogen (PBG) dimerisiert. Vier PGB-Einheiten werden zu verschiedenen Uroporphyrinogenen (UPG I, II, III) verknüpft, die mittels des Enzyms Uroporphyrinogen-III-Methyltransferase methyliert werden. Danach entsteht in einer Kette von ca. 30 Reaktionsschritten aus UPG ein biologisch aktives Corrinoid wie z.Bsp. das Cobalamin.[2] Viele höhere Lebewesen wie Wirbeltiere, einige Mollusken sowie wenige Crustaceen und Insekten synthetisieren auf einem ähnlichen Weg das strukturell verwandte, aber Eisen statt Cobalt enthaltende Hämoglobin; ihnen fehlt die Möglichkeit, die Methinbrücke zwischen den beiden in Corrinoiden direkt verbundenen Pyrrol-Untereinheiten zu entfernen.
Siehe auch
Quellen
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Lena I. Vorobjeva: Propionibacteria, S. 161, Veröffentlicht 1999, Springer-Verlag, ISBN 0-79235884-8
Wikimedia Foundation.
