- Devarda
-
Allgemeines Name Devardasche Legierung Andere Namen - Devarda
- Devardsche Legierung
Summenformel Al9Cu10Zn CAS-Nummer 8049-11-4 Kurzbeschreibung graues, geruchloses Pulver Eigenschaften Molare Masse nicht angebbar, da keine exakte festgelegte Mischung Aggregatzustand fest
Dichte 5,79 g·cm−3[1]
Schmelzpunkt 490–560 °C [1]
Siedepunkt 906 °C [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Leicht-
entzündlich(F) R- und S-Sätze R: 11 S: 16-33-7/9 WGK 3 (stark wassergefährdend)[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.
Die Devardasche Legierung, auch Legierung nach Devarda oder kurz Devarda genannt, ist eine nach dem italienischen Chemiker Arturo Devarda (1859-1944) benannte Legierung aus 45 % Aluminium, 50% Kupfer und 5% Zink. Das spröde, graue Metallgemisch dient vor allem in der analytischen Chemie als starkes Reduktionsmittel. Zu den wichtigsten Anwendungen der Legierung gehört der Nachweis von Nitrat und die quantitative Bestimmung von Nitraten, beispielsweise in Düngemitteln oder in Abwasser.Die Legierung ist so spröde, dass sie im Mörser pulverisiert werden kann. Sie hat dadurch und aufgrund ihrer Zusammensetzung folgende Vorteile:
- Sie kann leicht zerteilt werden, was die Anwendung kleiner Mengen, z.B. für Analysen im Mikromaßstab sehr erleichtert und eine angepasste Dosierung gestattet, so dass sie im Vergleich zu Aluminiumgranalien eine flexiblere Anwendung gestattet.
- Durch die große Oberfläche der fein zermörserten Legierung erfolgt eine schnellere Reaktion.
- Frisch zerteiltes Metall hat gegenüber Zink- oder Aluminiumpulver den Vorteil, nicht im selben Maße mit einer passivierenden Oxidschicht bedeckt zu sein. Auch der hohe Kufergehalt der Legierung trägt dazu bei, dass sich weniger solcher Schichten bilden als bei reinem Al oder Zn.
- Das Kupfer wirkt durch die Ausbildung eines Lokalelements katalytisch, d.h. Reduktionen mit Devardascher Legierung verlaufen deutlich schneller als bei Anwendung von Zink oder Aluminium.
- Reduktionen mit Aluminium erfordern oft eine stark alkalische Lösung. Im Gegensatz dazu sind Reduktionen mit Devardascher Legierung auch schon in schwach alkalischer Lösung oder sogar in neutraler Lösung durchführbar, auch wenn die Reaktion in neutraler Lösung wesentlich länger dauert.
Oft wird die Legierung im stark alkalischem Milieu verwendet. Die Zusammensetzung käuflicher Legierungen variieren im Bereich 44−46% Aluminium, 49−51% Kupfer und 4-6% Zink.
Inhaltsverzeichnis
Reaktion mit Säuren oder Laugen
In Säuren oder Laugen lösen sich das Aluminium und das Zink auf, wobei sich Wasserstoff entwickelt:
Al + 3 H+ → Al3+ + 1,5 H2
bzw. 2 Al + 2 OH− + 6 H2O → [Al(OH)4]− + 3 H2
Zn + 2 H+ → Zn2+ + H2
In nichtoxidierenden, sauerstofffreien Säuren wird das meiste Kupfer ungelöst bleiben. Die reduzierende Wirkung bei der Anwendung der Legierung wird in vielen Fällen auf der Reaktivität des entstehenden Wasserstoffs beruhen.
Nachweis von Nitraten
Devarda wird für den Nachweis von Nitraten verwendet. Versetzt man eine Nitrat enthaltende Probe mit Devarda und Natronlauge und erhitzt die Lösung vorsichtig, so wird das Nitrat zu gasförmigem Ammoniak reduziert, was durch seinen charakteristischen Geruch leicht identifizierbar ist:
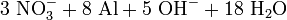
- die Na-Ionen der Natronlauge und das (beliebige) Kation des Nitrates wurden in der Formel weggelassen
Kjeldahlsche Stickstoffbestimmung
Bei der Kjeldahlschen Stickstoffbestimmung werden zunächst nur als Amine, Amide oder in Heterocyclen vorhandene Stickstoffanteile nach Umsetzung mit konzentrierter Schwefelsäure bestimmt. Zum weiteren Nachweis von Stickstoff aus Azo- oder Nitrogruppen müssen diese – ähnlich wie Nitrate – zunächst reduziert werden, was mit Devardscher Legierung geschehen kann.
Einzelnachweise
Wikimedia Foundation.

![\mathrm{\longrightarrow 3\ NH_3 + 8\ [Al(OH)_4]^{-} }](/pictures/dewiki/100/dd241b67705ff6e8b49f4269222ebd12.png)