- Dieckmann-Kondensation
-
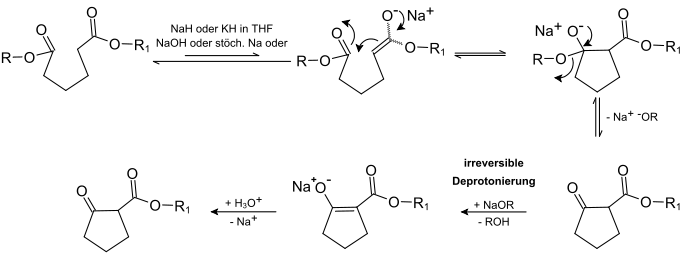
Unter einer Dieckmann-Kondensation versteht man in der Chemie eine intramolekulare Claisen-Kondensation von Dicarbonsäureestern zu cyclischen β-Ketoestern. Die Reaktion ist benannt nach dem deutschen Chemiker Walter Dieckmann (1869–1925).[1][2] Der Mechanismus ist mit dem der Claisen-Kondensation identisch, jedoch erfolgt ein vollständiger Ablauf der Reaktion nur mit einer stöchiometrischen Menge an Base, die in Form von Alkoholaten, Natriumamiden oder Hydriden der Alkalimetalle vorliegt. Bei dem β-Ketoester handelt es sich um eine methylenaktivierte Verbindung. Da das zu beiden Carbonylkohlenstoffen α-ständige Proton azide ist, kann es abstrahiert werden. Die Deprotonierung besitzt eine hohe Triebkraft und ist praktisch irreversibel. So kann das Gleichgewicht zur Seite des gewünschten Produktes verschoben werden. Ist die Reaktion abgeschlossen, setzt man dem Ansatz Säure zu, um das Anion zu neutralisieren, wobei auch alle Alkoholationen ebenfalls protoniert werden und eine Rückreaktion ausgeschlossen ist. Die Produkte einer Dieckmann-Kondensation sind fünf- bis achtgliedrige, cyclische β-Ketoester. Unter bestimmten Voraussetzungen können Ringe bis über zwölfgliedrige Ringe erreicht werden.[3]
Literatur
- R. Brückner: Reaktionsmechanismen, 3. Auflage, 2003, S. 572 f, ISBN 978-0-12-429785-2.
Siehe auch
Einzelnachweise
- ↑ Walter Dieckmann, Ber. Dtsch. Chem. Ges. 1894, 27, 102−102.
- ↑ Walter Dieckmann, Ber. Dtsch. Chem. Ges. 1894, 27, 965−966.
- ↑ László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis, Elsevier Academic Press, Amsterdam 2005, S. 138−139, ISBN 978-0-12-369483-6.
Wikimedia Foundation.