- Acyloin-Kondensation
-
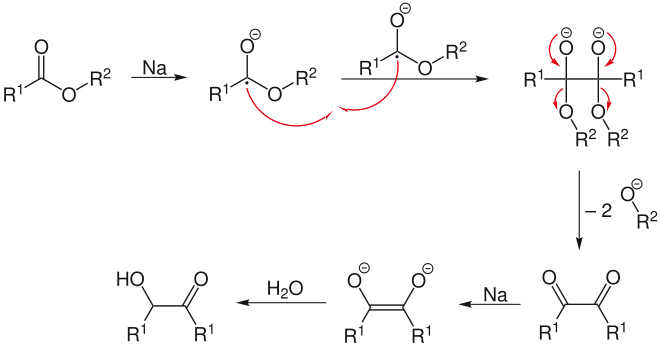
Die Acyloin-Kondensation ist eine Namensreaktion in der Organischen Chemie. Unter ihr versteht man die Kondensation zweier Ester zu α-Hydroxycarbonylverbindungen (Acyloin). Die Reaktion erfolgt durch Umsetzung in der Wärme mit Natrium in Toluol oder Xylol.
Inhaltsverzeichnis
Mechanismus
Zuerst reagiert der Ester mit Natrium zum Radikalanion, das daraufhin zum Dianion dimerisiert. Durch Abspaltung von zwei Alkoholat-Resten (R2O−) entsteht ein Diketon, welches mit überschüssigem Natrium zum Dianion reduziert wird. Dieses Dianion wird dann bei wässriger Aufarbeitung zum α-Hydroxyketon hydrolysiert.
Rühlmann-Variante
Zur drastischen Verbesserung der Ausbeute kann Trimethylsilylchlorid zugesetzt werden, das als Abfangreagenz für die basischen Alkoholate dient und Konkurrenzreaktionen (Dieckmann-Kondensation) effektiv zurückdrängt. Dies ist als Rühlmann-Variante der Acyloin-Kondensation bekannt.[1]
Intramolekulare Variante
Auch die intramolekulare Variante (Prelog-Stoll-Cyclisierung) ist aus Edukten mit zwei Estergruppen möglich. Über diese Methode sind aus entsprechenden Dicarbonsäure-diestern entsprechende Ringsysteme zugänglich - je nach Kettenlänge des Einsatzmaterials. Die Ausbeuten für die cyclische Variante variieren in Bezug auf die Kettenlänge - einige Systeme bilden sich leichter als andere. Von präparativer Bedeutung ist vor allem die Bildung von größeren Ringen (10- oder 12-gliedrige) unter Anwendung des Ziegler-Ruggli-Verdünnungsprinzips. Die Gegenwart von Doppel- oder Dreifachbindungen im Kohlenstoffsystem stört die Reaktion im Allgemeinen nicht.
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie; S. Hirzel Verlag, Stuttgart - Leipzig 1998, 23. überarb. und aktualisierte Auflage; ISBN 3-7776-0808-4
Einzelnachweise
- ↑ K. Rühlmann, Synthesis, 1971, 236–253. ISSN 0039-7881, doi:10.1055/s-1971-21707
Wikimedia Foundation.