- Dipeptidyl-Peptidase IV
-
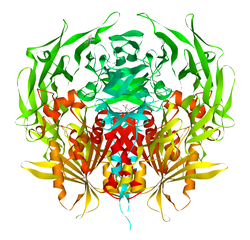
Dipeptidylpeptidase 4 Bändermodell nach PDB 1PFQ Vorhandene Strukturdaten: 1j2e, 1n1m, 1nu6, 1nu8, 1pfq, 1r9m, 1r9n, 1rwq, 1tk3, 1tkr, 1u8e, 1w1i, 1wcy, 1x70, 2ajl, 2bgn, 2bgr, 2bub, 2fjp, 2g5p, 2g5t, 2g63, 2hha, 2i03, 2iit, 2iiv, 2ogz, 2oph, 2oqi, 2oqv, 2p8s Größe 766 / 728 Aminosäuren Struktur löslich / single pass Typ 2 Membranprotein; Homodimer; Heterodimer Bezeichner Gen-Namen DPP4; ADABP; ADCP2; CD26; DPPIV; TP103 Externe IDs OMIM: 102720 UniProt: P27487 MGI: 94919 CAS-Nummer: 54249-88-6 Enzymklassifikation EC, Kategorie 3.4.14.5 Serinprotease MEROPS S09.003 Reaktionsart Hydrolyse, spaltet Dipeptide vom N-terminalen Ende eines Peptides ab Substrat Oligopeptide und auch Polypeptide (bevorzugt Peptide mit Prolinresten in der P1-Position) Produkte kürzere Peptide + Dipeptide Vorkommen Homologie-Familie Dipeptidylpeptidase 4 Übergeordnetes Taxon Lebewesen Das Enzym Dipeptidylpeptidase 4 (Kurzformen: DPP 4, auch DPP IV, DP IV) ist ein proteolytischer Biokatalysator der den sogenannten Exopeptidasen zugeordnet wird. Er spaltet vom N-terminalen Ende eines Peptides Dipeptide ab, wenn sich in AS2-Position bevorzugt Prolin- oder Alaninreste befinden. Wenn dagegen bei AS3 ein Prolinrest steht, wird das Peptid nicht angegriffen.
Inhaltsverzeichnis
Einleitung
Schon vor einigen Jahren stellte Yaron (Israel) eine Reihe von biologisch aktiven Peptiden vor, die als potentielle Subsatrate der DP IV fungieren können. Sie alle haben die N-terminale Sequenz AS-Pro-.... . Einige dieser Substanzen wurden experimentell geprüft und sie konnten als Substrate der Dipeptidylpeptidase 4 bestätigt werden. Dabei stellte sich heraus, dass durch die katalytische Hydrolyse (Spaltung) die biologische Wirkung ausgeschaltet oder geschwächt bzw. verstärkt wird. Es ist auch möglich, dass sich eine biologische Wirkung aus einem inaktiven Vorläufer erst ausbildet, oder dass keine Spaltung durch DP IV erfolgt. Dazu einige Beispiele:
Wirkungen
Casomorphine
Die Casomorphine sind kurzkettige Peptide, die erstmals aus dem β-Casein der Kuhmilch gewonnen wurden (Henschen, Brantl und Teschemacher, Max-Planck-Institute Martinsried und München). Sie sind in der Sequenz des Proteins enthalten und können aus ihm isoliert werden. Es handelt sich bei den Rinder-Casomorphinen um ein Heptapeptid und ein Pentapeptid. Beide Verbindungen haben physiologisch eine opioide Aktivität (etwa 4 % der des Morphins). Das Pentapeptid entsteht aus dem Heptapeptid durch C-terminale Sequenzverkürzung mittels Carboxypeptidase Y. β-Casomorphin-5 wird durch Dipeptidylpeptidase 4 weiterhin schrittweise abgebaut und dabei inaktiviert:
- β-Casomorphin-5: Tyr-Pro-Phe-Pro-Gly
Substanz P
Die physiologisch aktive Substanz P wird durch DP IV limitierend hydrolysiert. Dabei kommt es zu einer messbaren Aktivitätserhöhung.
- Substanz P: Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2
Melittin
Sehr interessant sind Arbeiten der Gruppe um Kreil aus Salzburg, das Gift der Honigbiene betreffend. Aus einem Vorläuferpeptid (Promelittin) wird durch Dipeptidylpeptidase 4 das Bienengift Melittin freigesetzt, indem Schritt für Schritt 10 Dipeptide der Sequenz AS-Pro und AS-Ala abgespalten werden:
- Promelittin: Ala-Pro-Glu-Pro-Glu-Pro-Ala-Pro-Glu-Pro-Glu-Ala-Glu-Ala-Asp-Ala-Glu-Ala-Asp-Pro-Glu-Ala-Melittin
Bradykinin
Bradykinin ist trotz der N-terminalen Arg-Pro-Sequenz nicht durch DP IV hydrolysierbar, da in AS3-Position ein Pro steht.
- Bradykinin: Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg
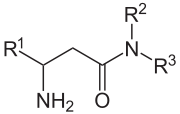
Inhibitoren
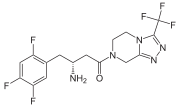
Durch Hemmung der katalytischen Aktivität der Dipeptidylpeptidase 4 ist es möglich, die Wirkung dieses Enzyms auszuschalten. Dies führt zu der Forderung nach der Entwicklung effektiver und spezifischer Inhibitoren der Dipeptidylpeptidase 4. Grundsätzlich sind die Spaltprodukte der Enzymwirkung potentielle Enzymhemmer, insbesondere die Verbindungen AS-Pro. Effektiver sind die decarboxylierten Derivate, also die AS-Pyrrolidide. Kürzlich sind die β-Aminoacyl-amide interessant geworden. Insbesondere Sitagliptin wurde im Oktober 2006 in den USA als Wirkstoff gegen Diabetes Typ II zugelassen, und als Arzneistoff unter dem Handelsnamen Januvia® vertrieben.
Bei der Wirkung der DP IV-Inhibitoren gegen Diabetes Typ II handelt es sich um einen grundsätzlich neuen Wirkmechanismus. Es ist bekannt, dass das Hormon Glucagon-like Peptid 1 (GLP-1) die Freisetzung des Insulins anregt. Dipeptidylpeptidase 4 baut GLP-1 ab. Inhibitoren der DP IV verhindern diesen Abbau und bewirken damit die Förderung der Insulinfreisetzung indirekt. Da dieser Mechanismus im Darm abläuft, ist eine orale Applikation möglich.
Vor einigen Jahren wurde durch einen Zusammenschluss von Forschungsgruppen der Universität Halle (Neubert), der Charite Berlin (Buntrock) und dem Betrieb Berlin-Chemie (Kaufmann) gefunden, dass die Substanz εZ(4-NO2)-Lys-Pro eine die Wundheilung fördernde Wirkungen besitzt, verbunden mit einer Stimulation der Bildung von Granulationsgewebe. Die Verbindung εZ(4-NO2)-Lys-Pro ist ein Dipeptidylpeptidase-4-Inhibitor. Falls ein kausaler Zusammenhang zwischen wundheilungsfördender Wirksamkeit und der DP IV Hemmung besteht, so ergibt sich eine interessante Schlussfolgerung: Die differenten kurativen Effekte werden zwar durch identische Rezeptoren (DP IV) ausgelöst, sie sind jedoch eine Folge unterschiedlicher Applikationsorte (bei den DP IV–Hemmern als Pharmaka gegen Diabetes Typ II erfolgt eine orale Anwendung in Tablettenform über den Darm. Im Gegensatz dazu wird bei der Wundheilung der Applikationsort durch die zu behandelnde Wunde bestimmt).
Siehe auch
Wikimedia Foundation.