Dipol-Dipol Wechselwirkungen
- Dipol-Dipol Wechselwirkungen
-
Bei Atombindungen innerhalb von Molekülen unterscheidet man anhand der Differenz der Elektronegativität zwischen den kovalenten oder unpolaren Bindungen (Differenz der Elektronegativität ist 0,0-0,4) und den polaren Bindungen (Differenz der Elektronegativität ist 0,5-1,7).
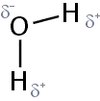
Partialladungen am Wassermolekül
Bei den polaren Bindungen werden die Bindungselektronen zu dem elektronegativeren Atom hin angezogen. Dadurch erhält das Molekül eine negative und eine positive Partialladung. Es liegt allerdings erst dann ein Dipol vor, wenn ein Ersatzvektor gebildet werden kann. Umgangssprachlich, aber wissenschaftlich gesehen falsch, spricht man davon, dass die "negativen und positiven Ladungsschwerpunkte nicht auf einen Punkt zusammenfallen".
So ist das Wasser-Molekül ein Dipol, das CH4-Molekül nicht.
Zwischen den Molekülen, die einen solchen Dipol bilden, herrschen Dipol-Dipol-Kräfte. Diese zwischenmolekularen Kräfte sind schwächer als die Kräfte bei den Wasserstoffbrückenbindungen, jedoch stärker als die Kräfte der Van-der-Waals-Bindungen.
Bestimmung von eventuell auftretenden Dipolen in Molekülen
1. Als erstes bestimmt man den räumlichen Bau des Moleküls.
2. Dann bestimmt man mit Hilfe der Elektronegativität eventuell auftretende Partialladungen und kennzeichnet sie mit δ- und δ+.
3. Man trägt zwischen den Partialladungen die Vektoren auf und schaut, ob evtl. mehr als zwei Ladungspole auftauchen. In diesem Fall muss man mit Hilfe eines Parallelogramms eine Vektoraddition durchführen und den „Ersatzvektor“ bestimmen.
Liegen in einer Verbindung verschiedene Partialladungen vor, kann man durch eine Vektoraddition bestimmen, ob die so genannten „Ladungsschwerpunkte“ zusammenfallen. Dipole sind also Moleküle, die einen Ladungsvektor aufweisen.
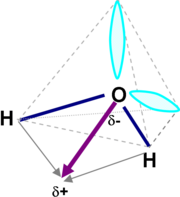
Dipol des Wassermoleküls
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Dipol-Dipol-Kräfte — zwischen zwei Chlorwasserstoffmolekülen (HCl) Als Dipol Dipol Kräfte oder Dipol Dipol Wechselwirkungen werden die Kräfte bezeichnet, die zwischen Molekülen herrschen, die ein permanentes elektrisches Dipolmoment besitzen. Die Stärke ist von der… … Deutsch Wikipedia
Van-der-Waals-Wechselwirkungen — Mit Van der Waals Kräften (Van der Waals Wechselwirkungen), benannt nach dem niederländischen Physiker Johannes Diderik van der Waals (1837–1923), bezeichnet man die relativ schwachen nicht kovalenten Wechselwirkungen zwischen Atomen oder… … Deutsch Wikipedia
Intermolekulare Wechselwirkungen — Mit zwischenmolekularen Kräften oder intermolekularen Kräften bezeichnet man elektromagnetische Wechselwirkungen zwischen Molekülen oder Bereichen von Makromolekülen. Man unterscheidet Ionische Wechselwirkungen Wasserstoffbrücken Dipolkräfte Van… … Deutsch Wikipedia
Indischer Ozean Dipol — Der Indische Ozean Dipol (IOD) bezeichnet eine natürlich vorkommende Meeresoberflächentemperaturanomalie (SST Anomalie) am äquatorialen Ost und Westende des Indischen Ozeans, sie macht etwa 12 % der gesamten Temperaturanomalien des Indik aus … Deutsch Wikipedia
Bindungsarten — Die chemische Bindung ist ein physikalisches Phänomen, durch das zwei oder mehrere Atome oder Ionen fest zu chemischen Verbindungen aneinander gebunden sind. Dieses beruht darauf, dass es für die meisten Atome oder Ionen energetisch günstiger ist … Deutsch Wikipedia
Metallcharakter — Die chemische Bindung ist ein physikalisches Phänomen, durch das zwei oder mehrere Atome oder Ionen fest zu chemischen Verbindungen aneinander gebunden sind. Dieses beruht darauf, dass es für die meisten Atome oder Ionen energetisch günstiger ist … Deutsch Wikipedia
Ebullioskopische Konstante — Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers Der Siedepunkt (Abkürzung: Sdp) oder auch Kochpunkt (Abk.: Kp) eines Reinstoffes ist ein Wertepaar in dessen Phasendiagramm und besteht aus zwei Größen: Der Sättigungstemperatur… … Deutsch Wikipedia
Kochpunkt — Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers Der Siedepunkt (Abkürzung: Sdp) oder auch Kochpunkt (Abk.: Kp) eines Reinstoffes ist ein Wertepaar in dessen Phasendiagramm und besteht aus zwei Größen: Der Sättigungstemperatur… … Deutsch Wikipedia
Molare Siedepunkterhöhung — Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers Der Siedepunkt (Abkürzung: Sdp) oder auch Kochpunkt (Abk.: Kp) eines Reinstoffes ist ein Wertepaar in dessen Phasendiagramm und besteht aus zwei Größen: Der Sättigungstemperatur… … Deutsch Wikipedia
Molare Siedepunktserhöhung — Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers Der Siedepunkt (Abkürzung: Sdp) oder auch Kochpunkt (Abk.: Kp) eines Reinstoffes ist ein Wertepaar in dessen Phasendiagramm und besteht aus zwei Größen: Der Sättigungstemperatur… … Deutsch Wikipedia


