- Wasserstoffbrückenbindung
-
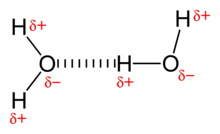 Zwei Wassermoleküle, schwach verbunden durch eine gestrichelt gezeichnete Wasserstoffbrücke.
Zwei Wassermoleküle, schwach verbunden durch eine gestrichelt gezeichnete Wasserstoffbrücke.
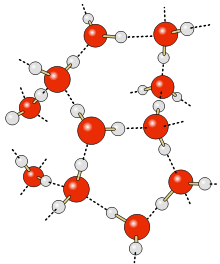
 Momentaufnahme einer Computersimulation von flüssigem Wasser. Gezeigt werden die einzelnen Wassermoleküle, Sauerstoff ist rot dargestellt, Wasserstoff weiß. Die Größenverhältnisse der Atome sind nicht maßstabgerecht, sondern nur die Abstände der Atomkerne. Die gestrichelten blauen Linien repräsentieren Wasserstoffbrücken. Zusätzlich ist die Länge der einzelnen Wasserstoffbrücken in Ångström vermerkt.
Momentaufnahme einer Computersimulation von flüssigem Wasser. Gezeigt werden die einzelnen Wassermoleküle, Sauerstoff ist rot dargestellt, Wasserstoff weiß. Die Größenverhältnisse der Atome sind nicht maßstabgerecht, sondern nur die Abstände der Atomkerne. Die gestrichelten blauen Linien repräsentieren Wasserstoffbrücken. Zusätzlich ist die Länge der einzelnen Wasserstoffbrücken in Ångström vermerkt.
Wasserstoffbrückenbindungen, auch kurz Wasserstoffbrücken oder H-Brücken, sind Bindungen elektrostatischer Natur. Sie sind eine Form der Nebenvalenzbindung und ihre Stärke liegt in der Regel deutlich unter denen der kovalenten Atombindung und der ionischen Bindungen. Sie beruht im Wasser darauf, dass die Wasserstoffatome und das Sauerstoffatom im Wassermolekül nicht auf einer geraden Linie liegen (H–O–H), sondern einen Winkel bilden, wodurch die elektrischen Ladungen asymmetrisch verteilt sind: am Sauerstoffatom negativ, an den Wasserstoffatomen positiv. Diese Ladungen benachbarter Moleküle ziehen sich gegenseitig an und so bilden sich Ketten und größere Gruppen (Cluster). Die einzelnen Wassermoleküle sind somit nicht frei beweglich und benötigen z. B. zum Übergang in den gasförmigen Zustand viel Energie, d. h., der Siedepunkt des Wassers liegt verhältnismäßig hoch.
In Proteinen halten Wasserstoffbrücken die wichtigen dreidimensionalen Strukturen der Moleküle aufrecht. In der DNA schließlich verbinden Wasserstoffbrücken die einzelnen Stränge zur charakteristischen Doppelhelix. Dieses Prinzip ist somit eine notwendige Voraussetzung für alle bekannten Lebewesen.
Inhaltsverzeichnis
Entdeckung
Das Konzept der Wasserstoffbrücken wurde erstmals 1920 von Wendell Mitchell Latimer und Worth H. Rodebush zur Erklärung der hohen Dielektrizitätskonstante von Wasser beschrieben. [1]
Entstehung der Bindung
Wasserstoffbrücken entstehen, wenn zwei funktionelle Gruppen über Wasserstoffatome in Wechselwirkung treten. Dabei ist es unerheblich, ob die Bindung zwischen zwei Molekülen oder zwei getrennten Abschnitten eines Makromoleküls entsteht. Man unterscheidet bei den funktionellen Gruppen zwischen dem Protonendonator (auch: Donor, Donator) und dem Protonenakzeptor. Der Donator ist ein elektronegatives Atom (z. B. Stickstoff, Sauerstoff oder Fluor), an das ein Wasserstoffatom kovalent gebunden ist. Durch den Unterschied in der Elektronegativität bilden sich hier zwei Teilladungen heraus. Eine negative an dem elektronegativen Atom, und eine positive an dem gebundenen Wasserstoffatom. Man spricht hier von einer polaren Bindung. Der Akzeptor ist ein beliebiges anderes elektronegatives Atom mit freien Elektronenpaaren.
Wenn Donator (−X−H) und Akzeptor (Y−) geometrisch so ausgerichtet sind, dass das freie Elektronenpaar des Akzeptors in die Richtung des Wasserstoffatoms zeigt, bildet sich eine Wasserstoffbrückenbindung. Im Allgemeinen stellt man ein solches System wie folgt dar:
Die punktierte Linie symbolisiert die Wasserstoff-Brückenbindung.
Dabei ist zu beachten, dass bestimmte funktionelle Gruppen gleichzeitig als Donator und Akzeptor agieren können. Ein einfaches Beispiel sind Hydroxygruppen oder die Wasserstoffbrückenbindungen zwischen Wassermolekülen.
Klassifizierung von Wasserstoffbrückenbindungen
George A. Jeffrey[2] hat eine Klassifikation von Wasserstoffbrückenbindungen eingeführt. Unterschieden wird hierbei die Stärke der Bindung.
- Starke Bindungen (63–167 kJ/mol): Beispielsweise in der Flusssäure H−F···H−F
- Mittlere Bindungen (17–63 kJ/mol): Beispielsweise in Wasser oder in Kohlenhydraten.
- Schwache Bindungen (< 17 kJ/mol): C−H···O-Interaktionen, zum Beispiel in Proteinen.[3]
Auswirkungen von Wasserstoffbrückenbindungen
Wasserstoffbrücken in Biomolekülen
Wasserstoffbrücken sind verantwortlich für die speziellen Eigenschaften vieler für Lebewesen wichtiger Moleküle:
- Proteine: Stabilisierung von Sekundärstrukturelementen wie α-Helix [4] und β-Faltblatt[5], sowie der Tertiärstruktur und Quartärstruktur (es treten bei Proteinen aber auch andere Bindungstypen auf).
- RNA: komplementäre Basenpaarung innerhalb von ncRNA-Molekülen oder zwischen RNA- und DNA-Molekülen.
- DNA: komplementäre Basenpaarung innerhalb der Doppelhelix; die beiden DNA-Stränge werden von den Wasserstoffbrückenbindungen zusammengehalten. Sie lassen sich jedoch (beim Kopiervorgang durch Helikasen) lösen („Reißverschluss“-Prinzip).
- Wirkstoffe: Die Bindungsaffinität von Wirkstoffen an ihre Zielstrukturen hängt maßgeblich von den gebildeten Wasserstoffbrücken ab.[6]
Wasserstoffbrücken in Wasserstoffverbindungen im Allgemeinen
Wasserstoffverbindungen von Elementen in der 6. Hauptgruppe haben eine tetraedrische Geometrie und jeweils zwei Möglichkeiten als Akzeptor und als Donator zu agieren. Jedes Molekül kann so vier Wasserstoffbrücken ausbilden, wodurch ein besonders dichtes Netzwerk von Wasserstoffbrücken entsteht. Zu diesen Verbindungen gehören unter anderem Wasser (H2O), Schwefelwasserstoff (H2S) und Selenwasserstoff (H2Se).
Bei einem Phasenübergang müssen diese Wasserstoffbrückenbindungen gebrochen werden. Daher haben sie im Vergleich zu den Wasserstoffverbindungen der anderen Elemente in ihrer jeweiligen Periode (die nicht so viele Wasserstoffbrücken ausbilden können) erhöhte Schmelz- und Siedetemperaturen.
Innerhalb dieser Hauptgruppe hat die Wasserstoffverbindung von Sauerstoff, also Wasser (H2O), die höchsten Schmelz- und Siedetemperaturen, weil Sauerstoff die höchste Elektronegativität hat und somit auch die stärksten Wasserstoffbrücken bilden kann. Die Wasserstoffverbindungen der Elemente im Verlauf der Gruppe („weiter unten“) sind weniger elektronegativ und bilden schwächere Wasserstoffbrücken. Daher ist bei ihnen die molare Masse der entscheidendere Faktor für die Schmelz- und Siedetemperaturen (von H2Se an steigen sie wieder an).
Element 6
C7
N8
O9
F15
P16
S17
Cl35
BrWasserstoffverbindung CH4 NH3 H2O HF PH3 H2S HCl H2Se HBr Schmelzpunkt in °C −182 −77 0 −83 −134 −85 −114 −66 −87 Siedepunkt in °C −162 −33 100 19 −88 −60 −85 −41 −67 Wasserstoffbrücken von Wasser im Speziellen
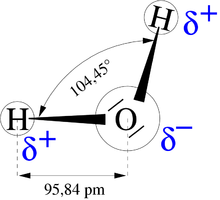 Polare Atombindungen des Wassermoleküls
Polare Atombindungen des Wassermoleküls
Durch die höhere Elektronegativität des Sauerstoffs mit 3,5 gegenüber der des Wasserstoffes mit 2,1 weist das Wassermolekül einen Dipolcharakter auf. Der Sauerstoff ist dadurch partiell negativ (δ−), der Wasserstoff partiell positiv (δ+). Die Wasserstoffbrücken bilden sich zwischen den unterschiedlichen Partialladungen aus.
Wasserstoffbrücken sind für eine Anzahl wichtiger Eigenschaften des Wassers verantwortlich. Darunter sind der flüssige Aggregatzustand bei Normalbedingungen, die Kohäsion, der relativ hohe Siedepunkt und die Dichteanomalie des Wassers
Die typische Bindungslänge von Wasserstoffbrückenbindungen in Wasser ist 0,18 nm. Es treten dabei zwei Typen von Bindungen auf. Sogenannte lineare Bindungen mit einem Bindungswinkel von 180° und nichtlineare 180° ± 20°, wobei die lineare Bindung überwiegt. Wohingegen ein rein tetraedrisches Netzwerk (Bindungswinkel 180°) zu jeweils 4 nächsten Nachbarn führen müsste (Koordinationszahl 4) ist die (durch Röntgenstreuung) gemessene Koordinationszahl unter Normalbedingungen 4,5.
Bei abnehmender Dichte erniedrigt sich dieses Ordnungsmaß (im Gegensatz zu einer Erhöhung der Koordinationszahl bei den meisten anderen Flüssigkeiten) auf 4 und damit auf den Wert für eine ideale tetraedrische Struktur.
Im Wasser sind vorwiegend 2, 4 oder 8 Wassermoleküle miteinander verbunden. Beim Verdampfen müssen diese getrennt werden; hierdurch erklärt sich auch der (im Vergleich zu anderen Substanzen) hohe Energieaufwand, um flüssiges Wasser von 100 °C in Dampf von 100 °C zu verwandeln (s. Verdampfungswärme).
Intramolekulare Wasserstoffbrückenbindungen
Treten innerhalb eines Moleküles mehrere Donatoren/Akzeptoren auf, so kann es innerhalb des Moleküles zu Wasserstoffbrückenbindungen kommen, wie etwa bei der Rizinolsäure. Dort ist sowohl eine Hydroxygruppe, als auch eine Carboxygruppe vorhanden. Eigentlich müsste die Hydroxygruppe den Schmelz- bzw. Siedepunkt erhöhen. Allerdings ist der Siedepunkt der Rizinolsäure sogar niedriger als der der Ölsäure, die sich nur durch die fehlende Hydroxygruppe unterscheidet, da die Hydroxygruppe mit der Carboxygruppe Wasserstoffbrückenbindungen eingeht. Die Carboxygruppe kann also nicht mehr in gleichem Ausmaß intermolekulare Wasserstoffbrückenbindungen eingehen als wenn die intramolekulare Hydroxygruppe nicht vorhanden wäre.
Auch die räumliche Struktur verändert sich; es entstehen aufgrund der Anziehungskräfte zwischen den polaren Gruppen pseudocyclische Strukturen.
Einzelnachweise
- ↑ Wendell M. Latimer, Worth H. Rodebush: Polarity and Ionization from the Standpoint of the Lewis Theory of Valence. In: Journal of the American Chemical Society. 42, 1920, S. 1419-1433, doi:10.1021/ja01452a015 ([1]).
- ↑ George A. Jeffrey: An Introduction to Hydrogen Bonding. Oxford University Press, 1997, ISBN 978-0195095494.
- ↑ Lin Jiang, Luhua Lai: CH⋯O Hydrogen Bonds at Protein-Protein Interfaces. In: J. Biol. Chem.. 277, Nr. 40, 2002, S. 37732–37740, doi:10.1074/jbc.M204514200.
- ↑ L. Pauling, R. B. Corey, H. R. Branson: The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain. In: Proceedings of the National Academy of Sciences of the United States of America. 1951, S. 205–211.
- ↑ L. Pauling, R. B. Corey: Configurations of polypeptide chains with favored orientations of the polypeptide around single bonds: Two pleated sheets. In: Proceedings of the National Academy of Sciences of the United States of America. 37, 1951, S. 729–740.
- ↑ M. A. Williams, J. E. Ladbury: Hydrogen Bonds in Protein-Ligand Complexes. In: H.-J. Böhm and Dr. G. Schneider (Hrsg.): Protein-Ligand Interactions. Wiley-VCH, Weinheim 2005, ISBN 978-3-52730521-6, S. 137-161, doi:10.1002/3527601813.ch6.
Literatur
- Allgemeine Lehrbücher
- Spezielle Bücher
- George A. Jeffrey: An Introduction to Hydrogen Bonding. Oxford University Press, 1997, ISBN 978-0195095494.
- George C. Pimentel, A.L. McClellan: Hydrogen Bond. W. H. Freeman & Co Ltd., San Francisco 1960, ISBN 978-0716701132.
- Anthony J. Stone, A. J. Stone: The Theory of Intermolecular Forces. Oxford University Press, Oxford 1997, ISBN 978-0198558835.
Weblinks
 Commons: Wassermolekül – Sammlung von Bildern, Videos und AudiodateienArten der Chemischen Bindung
Commons: Wassermolekül – Sammlung von Bildern, Videos und AudiodateienArten der Chemischen BindungIonische Bindung | Kovalente Bindung | Metallische Bindung | Koordinative Bindung
Intermolekulare Wechselwirkungen (Wasserstoffbrücken, Van-der-Waals-Kräfte)
Delokalisierte π-Bindung | Delokalisierte σ-Bindung (Dreizentrenbindung, Vierzentrenbindung)
Wikimedia Foundation.
Schlagen Sie auch in anderen Wörterbüchern nach:
Wasserstoffbrückenbindung — Was|ser|stoff|brụ̈|cken|bin|dung 〈f. 20〉 eine schwache Form der chem. Bindung, die sich zw. einem an elektronegative Elemente kovalent gebundenen Wasserstoffatom u. einem anderen elektronegativen Atom ausbildet, eine zwischenmolekulare Kraft, die … Universal-Lexikon
Flip-flop-Wasserstoffbrückenbindung — Flịp flọp Was|ser|stoff|brü|cken|bin|dung [engl. flip flop = elektronische Kippschaltung]: ↑ Wasserstoffbrückenbindung … Universal-Lexikon
E949 — Eigenschaften … Deutsch Wikipedia
E 949 — Eigenschaften … Deutsch Wikipedia
Flüssigwasserstoff — Eigenschaften … Deutsch Wikipedia
Hydrogenium — Eigenschaften … Deutsch Wikipedia
Hydrogensalze — Eigenschaften … Deutsch Wikipedia
LH2 — Eigenschaften … Deutsch Wikipedia
Naszierender Wasserstoff — Eigenschaften … Deutsch Wikipedia
Protium — Eigenschaften … Deutsch Wikipedia