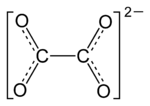
- Ethandioat
-
Als Oxalate oder Ethandioate werden die Salze und die Ester (Oxalsäureester) der Oxalsäure bezeichnet. Oxalat ist das Anion der Oxalsäure. Da Oxalsäure, aber auch deren Salze, mit Calcium (wird für den Knochenbau benötigt) ein schwer lösliches Salz bildet, kann dieses dann nur langsam ausgeschieden werden. Daher sollte Oxalsäure und deren Salze nur in geringen Dosen konsumiert werden. Oxalsäure ist auch in Schokolade und Rhabarber vorhanden.
Viele salzartige Oxalate sind in Wasser schwer löslich. In wässriger Lösung kann die Konzentration der Oxalat-Ionen durch Titration mit KMnO4-Lösung bestimmt werden, jedoch muss man die Oxalatlösung vorher auf 70 °C erwärmen.
Reaktion bei der Titration:
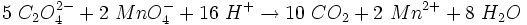
Am besten in Wasser löslich sind Ammoniumoxalat ((NH4)2(COO)2) und Natriumoxalat. Die Fällung des schwerlöslichen Calciumoxalat dient als gängiger Nachweis von Calciumionen.
Nachweisverfahren für Oxalate
Die Oxalat-Lösung wird mit Essigsäure/Acetat-Puffer gepuffert, der pH-Bereich liegt zwischen 4 und 6, dann Calciumchlorid-Lösung zugegeben, als Ergebnis entsteht ein weißer Niederschlag von Calciumoxalat (in rhombischer Kristallform). Da ein weißer Niederschlag auch durch andere Ionen gebildet wird, filtriert man den Niederschlag ab und löst ihn in verdünnter Schwefelsäure, tropft einen Tropfen Kaliumpermanganat dazu und erwärmt die Probe. Durch das Erwärmen muss sich die durch Kaliumpermanganat gefärbte Lösung entfärben.
Wikimedia Foundation.