- Etoricoxib
-
Strukturformel 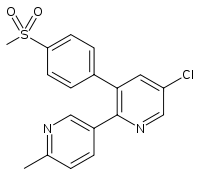
Allgemeines Freiname Etoricoxib Andere Namen IUPAC: 5-Chlor-6′-methyl- 3-[4-(methylsulfonyl)phenyl]- 2,3′-bipyridin
Summenformel C18H15ClN2O2S CAS-Nummer 202409-33-4 ATC-Code M01AH05
Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: ja Eigenschaften Molare Masse 358,84 g·mol−1 Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Etoricoxib ist ein Arzneistoff, der als Schmerzmittel aus der Klasse der COX-2-Hemmer (Nicht-steroidale Antirheumatika, NSAR) zur Behandlung der Arthrose, der rheumatoiden Arthritis und bei akuten Gichtanfällen angewendet wird. Etoricoxib ist in Deutschland seit September 2004 für Personen ab 16 Jahren zugelassen.
Inhaltsverzeichnis
Indikationen
Etoricoxib ist in Deutschland zugelassen für:
Pharmakokinetik
Halbwertzeit 22 Stunden. Das Präparat flutet sehr schnell an und erreicht nach ca. einer Stunde den höchsten Wirkspiegel. Dadurch ist ein sehr schneller Wirkeintritt zu erwarten, nach Studienlage im Mittel nach 25 Minuten. Die Zulassungsstudien bei akuter Gichtarthritis liefen gegen 3 × 50 mg Indometacin, eine gleiche Wirksamkeit konnte gezeigt werden. Bei Arthrose und Rheumatoider Arthritis wurde gegen 3 × 50 mg Diclofenac oder 2 × 500 mg Naproxen verglichen, jeweils mit dem Ergebnis gleicher Wirksamkeit.
Nebenwirkungen
Das Präparat kann wie alle NSAR zu arterieller Hypertonie und Ödemen führen.
Bezüglich des kardiovaskulären Sicherheitsprofils waren bisher nur Daten über einen Zeitraum von 12 bis 15 Monaten bekannt. Dort hat sich ein erhöhtes Risiko gegenüber Naproxen gezeigt. Seit November 2006 ist das Ergebnis der MEDAL-Studie publiziert, die an ca. 34000 Patienten durchgeführt wurde.[2] Die eigentliche MEDAL-Studie wurde mit Etoricoxib (60 mg und 90 mg) gegen Diclofenac 150 mg durchgeführt. Der primäre Endpunkt war kardiovaskuläre, thrombotische Ereignisse (tödlich oder nicht tödlich). In dieser Studie konnte kein Unterschied zwischen Diclofenac und Etoricoxib hinsichtlich der kardiovaskulären Sicherheit festgestellt werden. Die Studie lief maximal über 3,5 Jahre, wobei über 12000 Patienten über 2 Jahre behandelt wurden. Sie (die Studie) wurde wegen der Wahl von Diclofenac als Vergleichssubstanz kritisiert, da bei Diclofenac im Gegensatz zu Naproxen auch ein erhöhtes kardiovaskuläres Risiko vorbekannt war; somit habe man gerade eine Vergleichssubstanz gewählt, die selbst ein vergleichsweise hohes Level an unerwünschten Nebenwirkungen im kardiovaskulären Bereich hat.
Etoricoxib verursachte unter 90 mg mehr Studienabbrüche wegen Ödemen und unter 60 mg und 90 mg mehr Studienabbrüche aufgrund von Bluthochdruck. Diclofenac war lebertoxischer (Studienabbrüche ca. 3 % vs. 0,3 %).Gastrointestinal (Magen/Darm-Trakt) war Etoricoxib besser verträglich als Diclofenac, jedoch nicht in allen Subgruppen.
Das MEDAL-Programm ist in den USA eine wichtige Zulassungsstudie für Etoricoxib. Die FDA hat die Zulassung nach Auswertung der Daten erneut abgelehnt.
Eine weitere mögliche Nebenwirkung von Etoricoxib und anderen COX-2-Hemmern sind Depressionen.[3]
Gegenanzeigen
Etoricoxib ist bei Niereninsuffizienz (mit einer Kreatinin-Clearance unter 30 ml/min) und schweren Leberfunktionsstörungen kontraindiziert. Gleiches gilt für akute Magengeschwüre und Magen/Darmblutungen. Dehydrierte Patienten (z. B. Leistungssportler mit zu geringer Flüssigkeitsaufnahme) sowie Schwangere und Stillende dürfen ebenfalls kein Etoricoxib erhalten.
Neubewertung der Gegenanzeigen
Nach einer Neubewertung der Klasse der Coxibe durch die US-amerikanische Food and Drug Administration (FDA) und die Europäische Arzneimittelagentur wurden folgende Gegenanzeigen für alle Coxibe neu aufgenommen:
Ischämische Herzerkrankungen wie:
- Herzinsuffizienz (NYHA II-IV)
- Klinisch gesicherte Koronare Herzkrankheit (KHK, z. B. Angina Pectoris) und/oder zerebrovaskuläre Erkrankungen (z. B. Schlaganfall)
Zusätzlich für Etoricoxib:
- Patienten mit einer arteriellen Hypertonie, deren Blutdruck nicht ausreichend kontrolliert ist.
Literatur
- C. Cannon et. al.: Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison, Lancet Online, 13. November 2006
- Kearney et. al.: Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials, British Medical Journal, 26. Juni 2006
Handelsnamen
Arcoxia (D, A, CH), Auxib (A) [4][5][6]
Einzelnachweise
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Berichterstattung und Links bei theheart.org.
- ↑ arznei-telegramm 2007; 38: S. 105.
- ↑ Rote Liste Online, Stand: August 2009.
- ↑ AM-Komp. d. Schweiz, Stand: August 2009.
- ↑ AGES-PharmMed, Stand: August 2009.
Weblinks
- Trends-in-Medicine, 2004 (PDF-Datei; 326 kB)

Bitte den Hinweis zu Gesundheitsthemen beachten!
Wikimedia Foundation.
