- Gleitfilamenttheorie
-
Unter dem kontraktilen Mechanismus versteht man die Wirkungsweise und die Interaktion der Muskelproteine, Enzyme, Ionen und Energieträger bei der Muskelkontraktion. Bei der Kontraktion von Muskeln gleiten Filamentproteine ohne Veränderung der Eigenlänge ineinander und verkürzen somit die Länge des Muskels. Diese sogenannte Gleitfilament- beziehungsweise Filamentgleittheorie der Brüder Andrew F. Huxley und Julian Huxley gilt allerdings noch nicht als vollständig bewiesen.
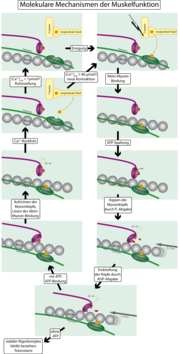
Bei den Filamentproteinen handelt es sich um Aktin, das äußere, dünne Filament, und Myosin, das innere, dicke Filament, welches sich durch Ruderbewegungen seiner Fortsätze am dünnen Filament vorbeischiebt und dadurch die Kontraktion ermöglicht.
Die Kontraktion auf Grundlage des „Querbrücken-Zyklus“ (Greifloslass-Zyklus) wird durch einen nervalen Impuls initiiert (Siehe Aktionspotenzial) und gibt modellhaft eine Erklärung für das Hineinwandern der Aktinfilamente in die Myosinzwischenräume.
- Bei Reduktion der Ca2+-Konzentration und Anlagerung von ATP am Myosinköpfchen löst sich dieser vom Aktinfilament. Um das Aktinfilament schlingen sich die so genannten Tropomyosinfäden, die in diesem Zustand die Bindungsstellen der Myosinköpfchen an dem Aktinfilament bedecken.
- Strömen als Folge von elektrischer Erregung Ca2+-Ionen ein, aktivieren diese die Enzymtätigkeit des Myosinköpfchens, welche der einer ATPase gleichzusetzen ist, sodass das angelagerte ATP in ADP (Adenosindiphosphat) und Pi (Phosphatrest) gespalten wird. Diese ATP-Spaltung führt zur Vorspannung des Myosinkopfes, vergleichbar mit dem Spannen einer Feder, durch sein Abklappen von etwa 45 auf etwa 90 Grad. Die einströmenden Ca2+-Ionen binden an den Troponinmolekülen des Tropomyosinfadens, wodurch sich seine Konformation/Position am Aktinfilament ändert und sich die Myosinköpfchen an dieses binden. Für diese Anlagerung wird vermutlich keine (ATP-)Energie benötigt.
- Das Aktin verursacht die Freisetzung des immer noch am Myosinköpfchen anliegenden Pi, kurz danach auch die des ADPs. Dadurch wird die Verspannung in mechanische Energie umgesetzt. Die Myosinköpfchen kippen wieder in ihre Ausgangsstellung zurück (ähnlich einem Ruderschlag) und ziehen dabei die Aktinfilamente von rechts und links zur Sarkomermitte.
Ein Querbrücken-Zyklus dauert 10-100 ms. Die Bindungsstelle für ATP am Myosinköpfchen ist nun wieder frei und der Vorgang kann von neuem beginnen, solange ATP vorhanden ist.
Pro geschlossene Querbrücke verkürzt sich das Sarkomer um ca. 1% seiner Länge. In erheblich weniger als 1 s kann sich das Sarkomer um ca. 50% seiner Ruhelänge verkürzen, was nur über etwa 50 Greif-Loslass-Zyklen in dem genannten Zeitraum erfolgen kann.
Die Beteiligung von Calcium-Ionen war erstmals durch Setsuro Ebashi nachgewiesen worden.
Siehe auch
Weblinks
Wikimedia Foundation.