- Hajos-Parrish-Keton
-
Strukturformel 
Allgemeines Name Hajos-Wiechert-Keton Andere Namen - (S)-(+)-Hajos-Parrish-Keton
- 5,6,7,8-Tetrahydro-8-methylindan-1,5-dion
- (7aS)-7a-Methyl-2,3,6,7-tetrahydroindol-1,5-dion
Summenformel C10H12O2 CAS-Nummer 17553-86-5 PubChem 736943 Eigenschaften Molare Masse 164,20 g·mol−1 Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37/38-43 S: 26-36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Das Hajos-Wiechert-Keton, auch Hajos-Parrish-Keton ist eine bicyclische chemische Verbindung.
Darstellung
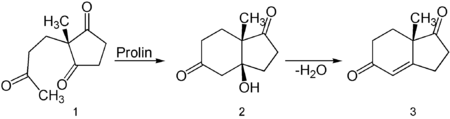
Die Verbindung kann auf organokatalytischem Wege erhalten werden. Die Aldoladdition zum (S)-(+)-Hajos-Parrish-Ketol 2 wird durch die natürliche Aminosäure (S)-(−)-Prolin katalysiert. Die Reaktion läuft bei Raumtemperatur ab.[2][3] Wird die Reaktion mit höherer Katalysatorbeladung und bei höherer Temperatur durchgeführt, so erhält man das (S)-(+)-Hajos-Wiechert-Keton 3, das durch Abspaltung von Wasser aus dem Hajos-Parrish-Ketol entsteht.[4] Wenn man die unnatürliche Aminosäure (R)-(+)-Prolin als Katalysator verwendet, erfolgt die Synthese die optische Enantiomere (R)-(−)-2 und (R)-(–)-3.[3] Das geschieht auch wenn man in der Reaktion anstatt von (S)-(+)-Prolin die β-Aminosäure (S)-Homoprolin als Katalysator anwendet [5].
Verwendung
Das Hajos-Wiechert-Keton (Hajos-Parrish-Keton) (S)-(+)-3 ist ein Synthesebaustein zur Totalsynthese von Steroiden und anderen natürlichen Verbindungen. So gelang beispielsweise die enantioselektive Totalsynthese von (+)-Cortistatin A ausgehend vom (S)-(+)-3[6] und der ent-Deoxycholsäure[7] ausgehend vom (R)-(−)-3 Hajos-Parrish-Keton.
Quellen
- ↑ Datenblatt der Firma Sigma-Aldrich
- ↑ Z. G. Hajos, D. R. Parrish: Asymmetric synthesis of bicyclic intermediates of natural product chemistry, in: J. Org. Chem. 1974, 39, 1615–1621.
- ↑ a b , Z. G. Hajos, D. R. Parrish, US Patent 3975440 1976.
- ↑ U. Eder, G. Sauer, R. Wiechert, in: Angew. Chem. Int. Ed. Engl. 1971, 10, 496–497.
- ↑ Michael Limbach: β-Homoamino acids as catalysts on enantioselective intra- and intermoelcular aldol reactions, Tetrahedron Letters 47 (2006) 3843-3847.
- ↑ H. M. Lee, C. Nieto-Oberhuber, M. D. Shair: Enantioselective Synthesis of (+)-Cortistatin A, a Potent and Selective Inhibitor of Endothelial Cell Proliferation, in: J. Am. Chem. Soc. 2008, 130, 16864–16866; doi:10.1021/ja8071918.
- ↑ B. W. Katona, N. P. Rath, S. Anant, W. F. Stenson, D. F. Covey: Enantiomeric Deoxycholic Acid: Total Synthesis, Characterization, and Preliminary Toxicity toward Colon Cancer Cell Lines, in: J. Org. Chem. 2007, 72, 9298–9307; doi:10.1021/jo701559q.
Wikimedia Foundation.