- Wieland-Miescher-Keton
-
Strukturformel 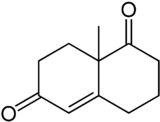
Allgemeines Name Wieland-Miescher-Keton Andere Namen - 9-Methyl-5(10)-octalin-1,6-dion
- 8a-Methyl-3,4,8,8a-tetrahydro-
-1,6(2H,7H)-naphthalindion
Summenformel C11H14O2 CAS-Nummer 20007-72-1 PubChem 89262 Kurzbeschreibung beigefarbener Feststoff[1]
Eigenschaften Molare Masse 178,23 g·mol−1 Aggregatzustand fest
Schmelzpunkt Siedepunkt Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Das Wieland-Miescher-Keton ist eine organisch-chemische Verbindung. Es handelt sich um ein bicyclisches Diketon, das außer einer Doppelbindung gesättigt ist.
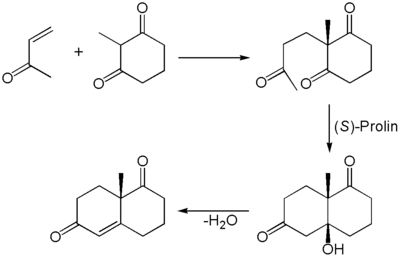
Das Wieland-Miescher-Keton ist nach seinen Entdeckern Peter Wieland und Karl Miescher benannt, die es bei Ciba-Geigy entwickelten.[3] Das eigentliche Wieland-Miescher-Keton wird racemisch durch eine Robinson-Anellierung gewonnen, von pharmazeutischem interesse ist jedoch die enantiomerenreine Darstellung.
Inhaltsverzeichnis
Darstellung
Das Wieland-Miescher-Keton wurde erstmals durch eine Robinson-Anellierung hergestellt. Der zweite Schritt der Robinson-Anellierung (Aldol-Reaktion) wurde hierbei auf organokatalytischem Wege über die Eder-Sauer-Wiechert-Hajos-Parrish-Reaktion durchgeführt. Als Organokatalysator diente enantiomerenreines (S)-Prolin wodurch das Produkt mit hoher Enantioselektivität erhalten werden konnte.[4]
Die Synthese kann auch als Eintopfreaktion durchgeführt werden.[5] Das Aldol-Zwischenprodukt wurde nur von Hajos und Parrish isoliert und in ihrem Patent beschrieben.[6]
Verwendung
Das Wieland-Miescher-Keton ist von synthetischem Interesse für die pharmazeutische Industrie. Es dient als Ausgangsverbindung zur Totalsynthese von Steroiden.
Siehe auch
Einzelnachweise
- ↑ a b c Datenblatt Wieland-Miescher-Keton bei Acros, abgerufen am 22. Februar 2010..
- ↑ Datenblatt Wieland-Miescher-Keton bei Sigma-Aldrich, abgerufen am 22. Februar 2010..
- ↑ P. Wieland, K. Miescher: Über die Herstellung mehrkerniger Ketone. In: Helv. Chim. Acta, 1950, 33, S. 2215, doi:10.1002/hlca.19500330730.
- ↑ P. Buchschacher, A. Fürst und J. Gutzwiller: (S)-3,4,8,8a-tetrahydro-8a-methyl-1,6(2H,7H)-naphthalenedione. In: Organic Syntheses, 1985, 63, S. 37.
- ↑ T. Bui, C. F. Barbas: A proline-catalyzed asymmetric Robinson annulation reaction. In: Tetrahedron Letters, 2000, 41, S. 6951–6954; doi:10.1016/S0040-4039(00)01180-1.
- ↑ Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 (29 July 1971) and USP 3,975,440 (Aug.17, 1976) Example 21.
Wikimedia Foundation.