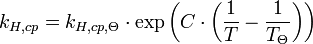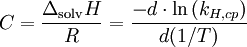- Henry-Koeffizient
-
Die Henry-Konstante kH , oft auch als Henry-Koeffizient bezeichnet, ist nach William Henry benannt und ist ein Maß für die Gasaufnahmefähigkeit einer Wasserphase/Lösung. Der flüchtige Stoff steht mit der flüssigen Phase im Lösungsgleichgewicht; damit ist die Henry-Konstante auch ein Maß für die Fugazität eines Stoffes.
Da mehrere Versionen des Henry-Gesetzes existieren, muss stets darauf geachtet werden, die der jeweils benutzen Formel entsprechende Henry-Konstante zu verwenden.
Einige Versionen des Henry-Gesetzes mit Konstanten (Gas in Wasser bei 298 K) Gleichung: 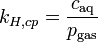
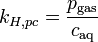
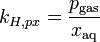
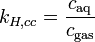
Einheiten: ![\left[\frac{\mathrm{mol}_\mathrm{gas}}{\mathrm{l} \cdot \mathrm{atm}}\right]](/pictures/dewiki/97/afa6b86103eb8211cd3374e338c1f1fc.png)
![\left[\frac{\mathrm{l} \cdot \mathrm{atm}}{\mathrm{mol}_\mathrm{gas}}\right]](/pictures/dewiki/57/9ffe3a0529943c7f016acfa5c55daa6e.png)
![\left[\frac{\mathrm{atm} \cdot \mathrm{mol}_\mathrm{wasser}}{\mathrm{mol}_\mathrm{gas}}\right]](/pictures/dewiki/100/dca65474f522b93939644df3899098fa.png)
[1] O2 1,3·10-3 769,23 4,259·104 3,180·10-2 H2 7,8·10-4 1282,05 7,099·104 1,907·10-2 CO2 3,4·10-2 29,41 0,163·104 0,8317 N2 6,1·10-4 1639,34 9,077·104 1,492·10-2 He 3,7·10-4 2702,7 14,97·104 9,051·10-3 Ne 4,5·10-4 2222,22 12,30·104 1,101·10-2 Ar 1,4·10-3 714,28 3,955·104 3,425·10-2 CO 9,5·10-4 1052,63 5,828·104 2,324·10-2 Einige weitere Beispiele (Löslichkeit in H2O) für Henry-Konstanten organischer Substanzen sind:
Halogenierte C1 und C2-Kohlenwasserstoffe kH,cp = 0,02 … 2 mol/l·bar Alkylbenzole (Butylbenzol - Benzol) kH,cp = 0,1 … 1 mol/l·bar Chlorbenzole (Hexachlorbenzol - Monochlorbenzol) kH,cp = 0,1 … 2 mol/l·bar Phthalatester kH,cp = 1000 … 2000 mol/l·bar Polyzyklische aromatische Kohlenwasserstoffe (PAK) kH,cp = 1 … 5000 mol/l·bar aliphatische Kohlenwasserstoffe (C18-C5) kH,cp = 0,0001 … 0,1 mol/l·bar PCB kH,cp(T) = 1 … 100 mol/l·bar Temperaturabhängigkeit der Henry-Konstante
Die Henry-Konstante ist bei Temperaturänderungen nicht konstant, weswegen sie manchmal auch als Henry-Koeffizient bezeichnet wird. Es gibt mehrere Ansätze diese Abhängigkeit in Formeln zu fassen, ein einfaches Beispiel ist:
Hier bei steht der Index Θ für die Normtemperatur (298 K).
Nachfolgende Tabelle listet einige Konstanten C (Einheit [K]) für die obige Formel auf:
Gas O2 H2 CO2 N2 He Ne Ar CO C 1700 500 2400 1300 230 490 1300 1300 Es zeigt sich, dass die Löslichkeit von Gasen in Wasser bei steigender Temperatur abnimmt. Erhitzt man beispielsweise mit Stickstoff gesättigtes Wasser von 25°C auf 95°C, so nimmt die Löslichkeit auf etwa 43 % des Anfangswertes ab. Dieses beobachtet man beim Erhitzen von Wasser in einem Kochtopf, kleine Gasblasen bilden sich und steigen auf (lange bevor die Flüssigkeit siedet!). Die Konstante C kann folgendermaßen interpretiert werden:
wobei ΔsolvH die Enthalpie der Lösung, und R die Gaskonstante ist.
Siehe auch
Weblinks
Wikimedia Foundation.