- Histon H1
-
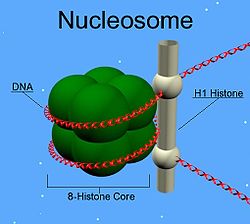
H1 histone family, member 0 Schemazeichnung Nukleosom mit Histon H1 (stabförmig) Vorhandene Strukturdaten: 1hst, 1ghc, 2fe2, 2rhi Masse/Länge Primärstruktur 193 Aminosäuren; 20,7 kDa Bezeichner Gen-Namen H1.0; H1F0; H1FV; H10 Externe IDs OMIM: 142708 MGI: 95893 Vorkommen Übergeordnetes Taxon Eukaryoten Orthologe Mensch Maus Entrez 3005 14958 Ensembl ENSG00000189060 ENSMUSG00000048769 UniProt P07305 P10922 Refseq (mRNA) NM_005318 NM_008197 Refseq (Protein) NP_005309 NP_032223 Genlocus Chr 22: 36.53 - 36.53 Mb Chr 15: 78.86 - 78.86 Mb PubMed Suche [1] [2] Histon H1 ist ein Protein, das im Zellkern vorkommt. Es ist eines der fünf Haupt-Histon-Proteine des Chromatins in eukaryotischen Zellen. Neben seiner Funktion als Gerüst für den DNA-Doppelstrang spielt es eine Rolle bei der Transkription. Es gibt mindestens sechs verschiedene Varianten von H1, die mit H1.1 bis H1.5 und H10 bezeichnet werden. Außer in einfachen Organismen wie der Bäckerhefe kommen alle Varianten in Tieren und Pflanzen vor.
Inhaltsverzeichnis
Biosynthese
Beim Mensch liegt das Gen für die Variante H1(0) auf Chromosom 22, alle anderen Varianten sind in einer Gruppe auf Chromosom 6 zu finden. Vom Translationsprodukt wird jeweils das Start-Methionin abgespalten. Die Länge und die Molekülmasse des resultierenden Proteins können aus der Tabelle abgelesen werden.
Variante Protein Länge (aa) Protein Masse (kDa) UniProt-Eintrag H1(0) 193 20,7 P07305 H1.1 214 21,7 Q02539 H1.2 212 21,2 P16403 H1.3 220 22,2 P16402 H1.4 218 21,7 P10412 H1.5 225 22,4 P16401 H1.T 206 21,9 P22492 Biologische Funktion
Histon H1 markiert die Position, an der sich die DNA um das Nukleosom schlingt. In der G1-Phase des Zellzyklus beginnt die Phosphorylierung des Proteins und schreitet bis zum Ende der Zelle fort, ist jedoch nicht gleich verteilt über den Zellkern; man vermutet, dass aktive (stark transkribierte) Gene und hoher Phosphorylierungsgrad von H1 zusammenhängen.
H1 wird auch poly(ADP-ribosyl)iert. Diese Veränderung, bei der 60 bis 80 ADP-Ribose-Moleküle an mehreren Stellen an H1 angehängt werden (beispielsweise durch das Enzym PARP-1), führt zu einer Öffnung des Nukleosoms und hängt mit der DNA-Reparatur zusammen.[1]
Andere Histon-Proteine
Siehe auch
Einzelnachweise
- ↑ Ronald Berezney, Kwang W. Jeon (Hrsg.): Structural and Functional Organization of the Nuclear Matrix Academic Press, 1995, ISBN 0123645654, S. 214-7
Wikimedia Foundation.