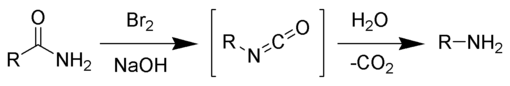- Hofmann-Umlagerung
-
Bei der Hofmann-Umlagerung (auch Hofmann-Abbau oder Hofmann-Säureamid-Abbau) wird ein unsubstituiertes Carbonsäureamid mit Brom Br2 in Gegenwart einer Base in Wasser umgesetzt. Dabei entsteht ein um die Carbonyl-Gruppe gekürztes Amin.[1][2][3] Die Reaktion ist nach ihrem Entdecker August Wilhelm von Hofmann benannt.
Reaktionsmechanismus
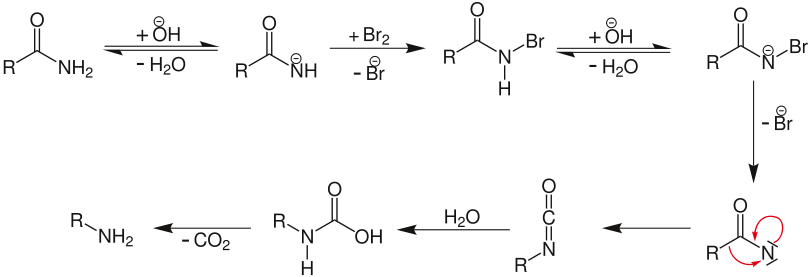
Im alkalischen Milieu bildet sich aus Brom das reaktive Hypobromit, das mit seiner positiven Partialladung die nucleophile Amingruppe angreift, es entsteht ein N-Bromamid. Dieses wird deprotoniert und unter Abspaltung von Bromid ließe sich als Intermediat das Nitren formulieren, das jedoch, analog zum entsprechenden Schritt bei verwandten Reaktionen wie der Curtius-Umlagerung, der Schmidt-Reaktion oder dem Lossen-Abbau, nicht tatsächlich als Zwischenprodukt zu formulieren ist. Vielmehr bildet sich in einer konzertierten Reaktion über eine Umlagerung das Isocyanat unmittelbar aus dem N-Bromamid. Das Isocyanat ist im wässrigen Medium der Reaktion nicht stabil, sondern reagiert sofort mit einem Hydroxid-Ion zum Carbamat. Nach Ansäuern wird die zugehörige Carbamidsäure freigesetzt, die decarboxyliert und das Amin ergibt.
Varianten
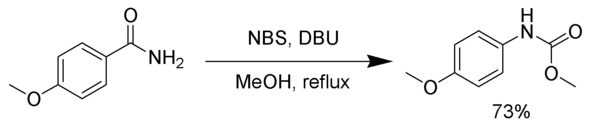
Brom kann durch andere Reagenzien, wie Chlor Cl2 oder N-Bromosuccinimid (NBS) mit 1,8-Diazabicyclo[5.4.0]undec-7-en (DBU) als Base ersetzt werden. Im folgenden Beispiel wird das intermediäre Isocyanat durch Methanol zu einem Carbamat umgesetzt.[4]
Als Alternative zu Brom kann auch (Bis(trifluoroacetoxy)iodo)benzenol eingesetzt werden.[5]
Quellen
- ↑ Hofmann, A. W. v. Ber. 1881, 14, 2725.
- ↑ Wallis, E. S.; Lane, J. F. Org. React. 1949, 3, 267-306 (Übersichtsartikel).
- ↑ Shioiri, T. Comp. Org. Syn. 1991, 6, 800-806 (Übersichtsartikel).
- ↑ Keillor, J. W.; Huang, X. Organic Syntheses, Coll. Vol. 10, S.549 (2004); Vol. 78, S.234 (2002). (Article).
- ↑ Almond, M. R.; Stimmel, J. B.; Thompson, E. A.; Loudon, G. M. Organic Syntheses, Coll. Vol. 8, p.132 (1993); Vol. 66, S.132 (1988). (Article).
Wikimedia Foundation.