- Isocyanat
-
Die Isocyanate leiten sich von der Isocyansäure ab. Dementsprechend unterscheidet man also (wie bei allen Säuren) die Salze (wie z. B. das Kaliumisocyanat) und die Ester.
Inhaltsverzeichnis
Ester der Isocyansäure
Herstellung
Isocyanate lassen sich durch Umsetzen von Phosgen mit den entsprechenden Aminen herstellen. Dabei wird in zwei Schritten Chlorwasserstoff abgespalten:
Da der Einsatz von Phosgen prinzipiell gefährlich ist, wird versucht, diesen Syntheseweg zu vermeiden, beispielsweise durch katalytische Carbonylierung von Nitro-Verbindungen oder Aminen.
Ein weiterer Syntheseweg ist die Umsetzung primärer Amine mit Boc2O in Anwesenheit von DMAP.
Chemische Eigenschaften
Die Isocyanate sind chemisch hochreaktive Verbindungen, die die Struktur R–N=C=O aufweisen. Die bedeutendsten Reaktionen der Isocyanatgruppe sind die Additionsreaktionen mit Alkoholen, Wasser oder Aminen. Aus der Polyadditions-Reaktion von Diisocyanaten (Verbindungen mit 2 Isocyanat-Gruppen) mit Diolen (zweiwertige Alkohole) entstehen die technisch vielfältig genutzten Polyurethane.
Urethanbildung:
Harnstoffbildung:
Reaktion mit Wasser:
![\mathrm{R{-}NCO + H_2O \longrightarrow [R{-}NHCOOH]}](/pictures/dewiki/56/807b0be32ee3f48a834a6f66d1cf966c.png)
- chemisch instabile Carbamidsäure
Das hier entstehende Kohlenstoffdioxid ist für die Schaumbildung bei Polyurethanschäumen verantwortlich. Das Amin wiederum kann mit einem Isocyanat, wie oben dargestellt, zu einem Harnstoff reagieren. Bei der Härtung von Polyisocyanaten mit Wasser werden also Polyharnstoffe gebildet. Es lassen sich so auch einkomponentige Produkte (Lacke, Klebstoffe, Schäume) formulieren, die das zur Härtung erforderliche Wasser als Wasserdampf aus der Umgebungsluft beziehen. Dünne Schichten härten ohne Aufschäumen aus, soweit das Basismaterial eine genügende Durchlässigkeit für Kohlendioxid besitzt.
Uretdionbildung:
Unter bestimmten Bedingungen können Isocyanate im Gleichgewicht zu Uretdionen dimerisieren.
Bei höheren Temperaturen ist die Lage des Gleichgewichts zu den thermisch stabileren Isocyanaten hin verschoben.
Industrielle Anwendung
Bei der Anwendung der Isocyanate muss unterschieden werden zwischen den sehr flüchtigen Monoisocyanaten und den deutlich weniger flüchtigen Di- und Polyisocyanaten.
Methylisocyanat (CH3–N=C=O) ist der einfachste Ester der Isocyansäure. Es ist eine sehr reaktive Substanz, die z. B. bei der Herstellung von Pestiziden verwendet wird. Wie die Isocyansäure und andere Isocyanate ist es sehr giftig.
Am 3. Dezember 1984 entwichen aus einem defekten Tank einer Pestizidfabrik des amerikanischen Chemiekonzerns Union Carbide Corporation in der Nähe der Stadt Bhopal (Indien) rund 40 Tonnen Methylisocyanat. Die Gaswolke tötete mehr als 2800 Menschen und verursachte bei mehreren Hunderttausend weiteren Personen schwere Verletzungen wie Augen- und Schleimhautschäden (Bhopalunglück).
Die Hauptanwendung der Diisocyanate stellen die Synthese der oben erwähnten Polyurethane dar. Die wichtigsten Vertreter sind:
- Toluol-2,4-diisocyanat (TDI)
- Diphenylmethandiisocyanat bzw. Methylendiphenyldiisocyanat (MDI)
- Hexamethylendiisocyanat (HMDI)
- Isophoron-diisocyanat (IPDI)
- 4,4’-Diisocyanatodicyclohexylmethan (H12MDI)
Die beiden letztgenannten aliphatischen Diisocyanate und ihre Derivate finden hauptsächlich in hochwertigen Polyurethan-Lacksystemen Verwendung.
Siehe auch
Salze der Isocyansäure
Die Salze der Isocyansäure haben keine besondere wirtschaftliche Bedeutung.
Medizinische Bedeutung
Isocyanate können allergische Reaktionen des Typ I und III (exogen-allergische Alveolitis) hervorrufen. Atemwegserkrankungen, die durch Isocyanate ausgelöst werden, können als Berufskrankheit (BK1315) anerkannt werden. Arbeitnehmer, die regelmäßig Isocyanaten ausgesetzt sind, müssen an arbeitsmedizinischen Vorsorgeuntersuchungen teilnehmen.
Wikimedia Foundation.


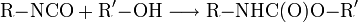
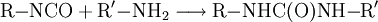
![\mathrm{[R{-}NHCOOH] \longrightarrow R{-}NH_2 + CO_2}](/pictures/dewiki/101/ec39fcf0808f8ee202bae1c5d88368ba.png)
