- Carbonsäureamide
-
Carbonsäureamide 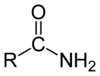
Allgemeine Struktur
eines primären Amids.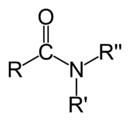
Allgemeine Struktur
eines primären,
N,N-Dialkylamids.Carbonsäureamide sind Derivate des Ammoniaks, sowie von primären und sekundären Aminen, bei denen ein oder mehrere Wasserstoffatome des Stickstoffs durch Carbonsäurereste (R-CO-) ersetzt sind. Carbonsäureamide sind eine Untergruppe der Amide. Je nachdem, wie viele Wasserstoffatome ersetzt sind, spricht man von primären, sekundären oder tertiären Amiden. Carbonsäureamide sind Reaktionsprodukte von Carbonsäurechloriden oder Carbonsäureanhydriden mit Ammoniak oder Aminen. Carbonsäuren selbst reagieren mit Ammoniak oder Aminen zum jeweiligen Ammoniumsalz, jedoch nicht zu Carbonsäureamiden.
Inhaltsverzeichnis
Nomenklatur
Bei Carbonsäureamiden unterscheidet man entsprechend der Anzahl der Carboxygruppen am Stickstoff zwischen primären (eine Carboxygruppe, zwei Wasserstoffatome), sekundären (zwei Carboxygruppen, ein Wasserstoffatom) und tertiären (drei Carboxygruppen, kein Wasserstoffatom) Amiden. Amide mit ein oder zwei Alkylgruppen am Stickstoffatom nennt man N-Alkylamide, bzw. N,N-Dialkylamide. Cyclische Amide werden als Lactame bezeichnet. Sekundäre Amide von Dicarbonsäuren werden Imide genannt. Peptide und Proteine bestehen aus – durch Amidbindungen verknüpften – Aminosäuren. Diese Form der Bindung wird oft Peptidbindung genannt. Technisch sehr bedeutend sind die Polyamidfasern Nylon und Perlon.
Struktur
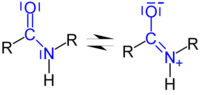
Da das Carbonyl-Kohlenstoff-Atom sp2-hybridisiert ist, liegen alle drei Atome der Amidbindung -CO-N= sowie deren Nachbaratome in einer Ebene. Weil weiterhin die Bindungslänge der C-N-Verbindung wesentlich kürzer (132 pm) ist, als in anderen Kohlenstoff-Stickstoffverbindungen (147 pm), muss ihr ein partieller Doppelbindungs-Charakter zugeschrieben werden. Diese Struktur wird durch die Mesomerie der Amidbindung zusätzlich stabilisiert. Das erklärt auch, warum das freie Elektronenpaar des Stickstoffs nichts zur Basizität beiträgt.
Vertreter
Carbonsäureamide Name Struktur Anmerkungen Formamid 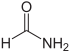
Das einfachste Amid, abgeleitet von der Ameisensäure und Ammoniak N,N-Dimethylformamid (DMF) 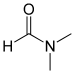
Verwendet als aprotisches Lösungsmittel in der organischen Chemie
und leitet sich von Dimethylamin und Ameisensäure ab.Acetamid (Ethanamid) 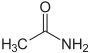
Amid der Essigsäure Harnstoff 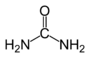
Ein Diamid, abgeleitet von der Kohlensäure. ε-Caprolactam 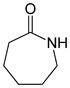
Ein cyclisches Carbonsäureamid. Ein Ausgangsstoff für Polyamide. Phthalimid 
das cyclische Imid der Phthalsäure. Weitere Beispiele siehe Kategorie:Amid, Kategorie:Lactam und Kategorie:Imid Darstellung
Amide werden hauptsächlich aus der Reaktion von Carbonsäurederivaten mit Ammoniak bzw. einem Amin gewonnen. Im einfachsten Fall handelt es sich bei dem Carbonsäurederivat um ein Carbonsäurechlorid. Das freigesetzte Chlorwasserstoff (HCl) reagiert mit dem Amin zu einem Hydrochlorid, weshalb das Amin in doppelter Menge eingesetzt werden muss:
Die Aminolyse von Carbonsäureestern liefert Carbonsäureamide und Alkohole:
Carbonsäuren selbst reagieren mit Aminen zu den entsprechenden Salzen:
Bei starken Erhitzen dissoziieren die Salze aber teilweise zu Amin und Carbonsäure, die dann unter Wasserabspaltung das Amid ergeben:
Weitere wichtige Verfahren zur Synthese von Amiden sind die Ritter-Reaktion, die Hydrolyse von Nitrilen, die Beckmann-Umlagerung und die Haller-Bauer-Spaltung.
Wikimedia Foundation.