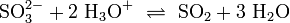- Hydrogensulfit
-
Sulfite sind die Salze und Ester der schwefligen Säure H2SO3. Die Salze enthalten als Anion das Sulfit-Ion (SO32−). Sie werden häufig als Konservierungsmittel in Wein, Trockenobst und Kartoffelprodukten eingesetzt. Sulfite treten allerdings auch natürlich in nahezu allen Weinen auf.
Ebenfalls als Sulfite bezeichnet werden die Ester der schwefligen Säure mit der allgemeinen Formel R-O-S(=O)-O-R′ (mit R und R′ als organische Reste).
Die schweflige Säure ist eine zweiprotonige Säure. Daher existieren unter den Salzen die
- Sulfite (MI2SO3), die auch normale, neutrale oder sekundäre Sulfite genannt werden und
- Hydrogensulfite (MIHSO3), die auch primäre oder saure Sulfite genannt werden.
Hydrogensulfite sind als feste Salze nicht existent und liegen nur in wässrigen Lösungen vor. Beim Einengen einer Lösung reagieren Hydrogensulfite unter Wasserabspaltung und Bildung einer Schwefel-Schwefel-Bindung zu Disulfiten (S2O52−):
Unter sauren Bedingungen setzen Sulfite und Hydrogensulfite Schwefeldioxid frei:
Inhaltsverzeichnis
Verwendung
Sulfite werden als Reduktionsmittel eingesetzt. Das Hydrogensulfit-Anion reagiert in chemischen Reaktionen als Nukleophil (z. B.: mit Aldehyden unter Bildung gut kristallisierender Salze). Wichtige Verfahren zur Herstellung von Zellstoff und Papier aus Holz arbeiten mit Sulfiten (vor allem Calciumhydrogensulfit, nach Mitscherlich).
Sulfite im Wein
Die Kennzeichnung „enthält Sulfite“ bzw. „enthält Schwefeldioxid“ ist nach Art. 3 Abs. 3 der Wein-Marktorganisations-Durchführungsverordnung – VO (EG) 753/2002 – bei Konzentrationen von mehr als 10 mg/l verbindlich vorgeschrieben. In den USA müssen Weine, die nach Mitte 1987 abgefüllt wurden, einen Hinweis auf Sulfite auf dem Etikett enthalten. Die entsprechende Regulierung in der EU gilt seit 2005. Die Kennzeichnungspflicht geht darauf zurück, dass Sulfite als „allergen“ angesehen werden.
Sulfite entstehen in geringen Mengen (10–30 mg/l) auf natürliche Weise während der alkoholischen Gärung (siehe: alkoholische Gärung) des Weines. Seit dem Ende des 18. Jahrhunderts ist die antimikrobielle sowie die antioxidative Wirkung des Schwefels bekannt. Seit dieser Zeit ist der Zusatz von Schwefel in der weltweiten Weinherstellung fest verankert. Weine haben generell einen Bedarf an Schwefeldioxid zwischen 90–400 mg/l. Schwefeldioxid (SO2) wird dem Wein gasförmig, in wässriger Lösung, als „Schwefelpulver“ (Kaliumdisulfit), in Form von Tabletten oder wie früher durch Ausbrennen von Fässern mit Schwefelspänen zugesetzt.
Sulfite ermöglichen, Weine über viele Jahrzehnte lang zu lagern, ohne dass die Weine durch Oxidation komplett „umkippen“. Außerdem verhindern sie unerwünschte Nachgärungen in der abgefüllten Flasche bei restsüßen Weinen, da sie Mikroorganismen (wie z. B. Hefen) effektiv an ihrer Arbeit hindern.
Entgegen manchen Meinungen enthalten auch Bioweine im Allgemeinen Sulfite.
Es gibt mancherorts Bestrebungen innerhalb der Weltweinbranche, Weine ohne Zusatz von Schwefeldioxid herzustellen. Vereinzelten konventionellen sowie auch Bioweingütern gelingt dies mit ordentlichem Erfolg seit einigen Jahren. Der Erfolg ist hauptsächlich der modernen Kellertechnologie zu verdanken. Edelsüße Weine ohne Schwefel herzustellen ist jedoch nicht möglich, da die hohen Restzuckergehalte (siehe: Restsüße) einen optimalen Nährboden für Mikroorganismen aller Art bieten.
Für Schwefeldioxid im Wein existieren nach EG-VO Höchstgrenzen.
Art des Weines EG-Höchstgrenze SO2 gesamt Rotwein < 5 g/l Restzucker 160 mg/l Rotwein > 5 g/l Restzucker 210 mg/l Weißwein & Roséwein < 5 g/l Restzucker 210 mg/l Weißwein & Roséwein > 5 g/l Restzucker 260 mg/l Spätlese und vergleichbare ausländische Weine 300 mg/l Auslese und vergleichbare ausländische Weine 350 mg/l Beerenauslese und Trockenbeerenauslese, Eiswein und vergleichbare ausländische Weine 400 mg/l Weine mit dem Hinweis „für Diabetiker geeignet“ 150 mg/l Nachweis
Der qualitative Nachweis kann indirekt mit Permanganaten erfolgen. Diese entfärben sich in einer Redoxreaktion, wenn Sulfite zugegen sind.
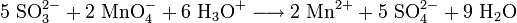
- Sulfit-Ionen reagieren mit Permanganat-Ionen in saurer Umgebung zu Mangan(II)-Ionen, Sulfat-Ionen und Wasser.
Die Reaktion ist nicht spezifisch für Sulfite und kann daher nur als Nachweis für Sulfite verwendet werden, wenn die Anwesenheit anderer Reduktionsmittel ausgeschlossen ist.
Beispiele
Salze der schwefligen Säure sind
- Kaliumsulfit
- Natriumsulfit
- Magnesiumsulfit
- Natriumhydrogensulfit
- Calciumhydrogensulfit (Calciumbisulfit).
- Ribéreau-Gayon, Dubourdieu, Donèche, Lonvaud: Traitè d'oenologie, 1. Microbiologie du vin, Vinifications. Dundo, Paris 2004, ISBN 2-10-007301-X.
Ester der schwefligen Säure sind
Siehe auch
Literatur
Weblinks
Wikimedia Foundation.


![\mathrm{2 \ HSO_3^- \ \rightleftharpoons \ [O_2S{-}SO_3]^{2-} + H_2O}](/pictures/dewiki/101/e644b64722fd93227bc5339b00975842.png)