- Lossen-Reaktion
-
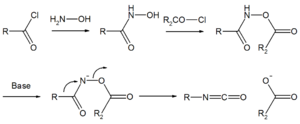
Die Lossen-Reaktion (auch Lossen-Abbau bzw. Lossen-Umlagerung) ist eine chemische Reaktion.[1] Hydroxamsäure-Derivate (in der Regel O-acylierte) werden am Stickstoff deprotoniert und lagern unter Abspaltung des Acyl-Restes in ein Isocyanat um. Sie ist eng verwandt mit dem Curtius-Abbau, dem Hofmann-Abbau bzw. der Schmidt-Reaktion. Sie wird vor allem verwendet, um Carbonsäurechloride zu primären Aminen abzubauen, es können jedoch auch je nach Reaktionsbedingungen Isocyanate oder Carbamate erhalten werden.
Die Reaktion wurde benannt nach ihrem Entdecker Wilhelm Lossen.
Reaktionsmechanismus
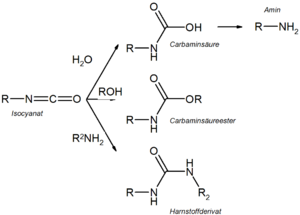
Hydroxamsäuren (=Carbonsäurehydroxylamine) entstehen durch nucleophile Substitution am Carboxylkohlenstoff aus Carbonsäurechloriden und Hydroxylamin. In Gegenwart einer Base lagern sie sich unter Abspaltung des Acyl-Restes zunächst in Isocyanate um. Die Reaktion wird als konzertiert, teilweise aber auch mit kurzlebigen Zwischenprodukten beschrieben (Nitrene, Elektronenmangelverbindungen mit einem Elektronensextett am Stickstoff). Bei Durchführung in einem inerten Lösungsmittel bleiben die Isocyanate Endprodukt der Reaktion, während sie in Gegenwart von Wasser zur entsprechenden Carbaminsäure weiterreagieren, die unmittelbar decarboxyliert und als Endprodukt das primäre Amin ergibt. In Gegenwart von Alkoholen entstehen stabile Carbaminsäureester (Carbamate) und von Aminen substituierte Harnstoffe.
Unsubstituierte Hydroxam-Säuren reagieren nicht, die Hydroxygruppe ist eine zu schlechte Abgangsgruppe.[2][3] Der Substituent R kann als π- oder σ- Donor die Reaktion ebenfalls erleichtern. In Hydroxam-Säuren mit chiralen Resten R* bleibt deren Konfiguration meist erhalten.
Eine interessante Variante ist die Umsetzung von Carbonsäurechloriden mit Hydroxylamin-O-Sulfonsäure Sommersche Säure.[4] In einer Einstufen-Reaktion zerfallen diese beim Erhitzen in Amine, Kohlendioxid und Schwefelsäure.[5]
Literatur
- Shiori, T. Comp. Org. Syn. 1991, 6, 821–825. (Review)
- Hauser, C. R.; Renfrow, Jr., W. B. Organic Syntheses, Coll. Vol. 2, p.67 (1943); Vol. 19, p.15 (1939). (Article)
- (Google-books)
- (Google-books)
Einzelnachweise
- ↑ W. Lossen: Annalen der Chemie 1872, 161, 347.
- ↑ Bauer, L.; Exner, O.: Angew. Chem. Int. Ed. Engl. 1974, 13, 376. (Review)
- ↑ Yale, H. L. Chem. Rev. 1943, 33, 209. (Review)
- ↑ Holleman-Wiberg 1976, 81-90. Auflage, 420.
- ↑ W. Lossen: Annalen der Chemie 1874, 175, 271.
Wikimedia Foundation.