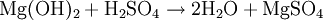- MgSO4
-
Strukturformel 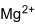
Allgemeines Name Magnesiumsulfat Andere Namen - Bittersalz
- Epsom-Salz
- Epsomit
Summenformel MgSO4
MgSO4 · 7 H2OCAS-Nummer - 7487-88-9 (Magnesiumsulfat)
- 10034-99-8 (MgSO4 · 7 H2O)
ATC-Code Kurzbeschreibung farbloser Feststoff [1][2] Eigenschaften Molare Masse Aggregatzustand fest [1]
Dichte Schmelzpunkt 1124 °C (Zersetzung) [1]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumsulfat MgSO4 ist neben Magnesiumhydrogensulfat Mg(HSO4)2 eines der beiden Magnesiumsalze der Schwefelsäure. Das auch als Mineral Epsomit auftretende Heptahydrat MgSO4·7 H2O (Heptahydrat) erhielt des bitteren Geschmacks wegen den Trivialnamen Bittersalz.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Magnesiumsulfat überwiegend als Kieserit, einem Monohydrat, vor.
Herstellung
Magnesiumsulfat lässt sich aus Magnesium und Schwefelsäure nach folgender Reaktionsgleichung herstellen:
Weiterhin entsteht es bei der Umsetzung von Magnesiumoxid oder Magnesiumhydroxid mit Schwefelsäure und anschließender Abdampfung des Wassers bzw. Trocknung:
Eigenschaften
Magnesiumsulfat ist ein farbloser, geruchloser, stark hygroskopischer Feststoff mit bitterem Geschmack. Es existieren mehrere Hydrate, von denen das wichtigste das Magnesiumsulfat-Heptahydrat MgSO4 · 7 H2O (Synonym: Bittersalz; Mineral Epsomit) ist.
Epsomit bildet farblose Kristalle, die ein rhombisch pseudotetragonales Kristallgitter ausbilden. Die Kristalle blühen oft in faserigen Aggregaten aus und bilden Stalaktiten. Epsomit ist gut wasserlöslich und hat eine Dichte von 1,68 g/cm³.
Verwendung
- Magnesiumsulfat wird als Magnesiumquelle für Pflanzen in Düngemitteln verwendet.
- Wegen seines hygroskopischen Charakters wird es in der organischen Chemie zur Trocknung von Stoffen benutzt. Dazu gibt man zu der zu trocknenden Flüssigkeit soviel wasserfreies Magnesiumsulfat, bis neu zugesetztes Magnesiumsulfat in der Flüssigkeit feinkörnig bleibt und nicht mehr verklumpt. Das Magnesiumsulfat kann anschließend abfiltriert werden.
- Als Bittersalz findet es schon lange Zeit in der Medizin als Abführmittel Verwendung. Seine starken Nebenwirkungen auf die Nierenfunktion können – vor allem bei Kindern – zu Problemen führen.
- Bittersalz wird auch verwendet, um ein Braunwerden der Nadeln bei Weihnachtsbäumen zu verhindern.
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 7487-88-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23. Dezember 2007 (JavaScript erforderlich)
- ↑ a b c Eintrag zu CAS-Nr. 10034-99-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23. Dezember 2007 (JavaScript erforderlich)
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.