- Michaelis-Menten-Konstante
-
Die Michaelis-Menten-Theorie (nach Leonor Michaelis und Maud Menten 1913) legt den Grundstein für die Enzymkinetik. Hier wurde das theoretische Rüstzeug erarbeitet, Enzyme nicht nur hinsichtlich ihrer Aktivität zu charakterisieren, sondern auch die Stoffmenge (Konzentration) zu finden, welche eine den Gegebenheiten angepasste Umwandlung ermöglicht (siehe auch: Affinität (Biochemie)).
Im Allgemeinen sind Enzyme in der Lage, schwankende Substrat-Konzentrationen auszugleichen, d. h. ein Fließgleichgewicht („steady state“) dadurch einzustellen, dass sie ihre Tätigkeit dem Angebot anpassen. Ausnahmen hiervon bestätigen die Regel, und dann aus naheliegenden Gründen. So gibt es zwei Glucose-umwandelnde Enzyme, die Glucokinase der Leber und der Bauchspeicheldrüse und die Hexokinase, die in nahezu jeder Zelle vorkommt. Erstere trägt dazu bei, schädliche Schwankungen des Blutzuckerspiegels auszugleichen, indem 1. die Leber die Glukose aus dem Blut aufnimmt und in Form von Glykogen speichert und 2. je nach Glukosekonzentration im Blut eine angemessene Menge Insulin aus der Bauchspeicheldrüse sezerniert wird. Die Hexokinase hingegen arbeitet stets an ihrer Leistungsgrenze, das heißt auch bei niedrigem Blutzucker. Dadurch werden, besonders unter Mangelbedingungen, vorrangig das Hirn und die roten Blutzellen, die auf Glukose als Energiequelle angewiesen sind, mit Energie versorgt. Anders gesagt: die Hexokinase findet auch in Notsituationen stets noch Glucose, arbeitet also mit maximaler Effizienz.
Inhaltsverzeichnis
Sättigung: das Phänomen
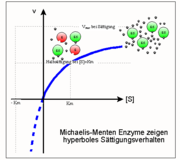
Im Gegensatz zur Kinetik chemischer Reaktionen gibt es in der Enzymkinetik das Phänomen der Sättigung: bei sehr hohen Substratkonzentrationen kann die Umsatzgeschwindigkeit v nicht weiter gesteigert werden d. h. es wird ein Wert Vmax erreicht.
theoretische Begründung
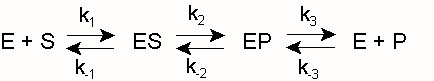
Als Biokatalysatoren bilden Enzyme E mit ihrem Substrat S einen Komplex ES (Enzym-Substrat-Komplex), aus dem heraus sich die Reaktion zum Produkt P vollzieht:
k1 und k -1 sind die Geschwindigkeitskonstanten für die Assoziation von E und S bzw. die Dissoziation des Enzym-Substrat-Komplexes ES. k2 und k -2 sind die entsprechenden Konstanten für die Reaktion zum Produkt bzw. die Rückreaktion zum Substrat. Diese Rückreaktion findet unter den Bedingungen der Enzymkinetik, d. h. unmittelbar nach Mischung der Komponenten E und S, noch nicht statt (siehe Fließgleichgewicht). Ferner wird die Umwandlung von ES zu EP (und nicht die spontane Freisetzung von P) gemessen, so dass die folgende Vereinfachung gerechtfertigt ist:Hierin ist k2 ein Maß der maximalen Reaktionsgeschwindigkeit bei Substratsättigung ( Vmax), auch Wechselzahl, molekulare Aktivität, „turnover number“ oder kcat genannt (kcat = Vmax/ [Eo]). Die Michaeliskonstante, die Substratkonzentration, die bei der Halbsättigung vorliegt (die Umsatzgeschwindigkeit also v = Vmax/2 beträgt), ergibt sich zu
(Michaelis-Menten-Fall, gegeben wenn k2<< k-1) oder allgemeiner zu
(Briggs-Haldane-Situation [Zerfallswege von ES/Bildungsweg von ES] für den Fall, dass k 2 gegenüber k 1 nicht vernachlässigt werden kann)
Sättigungsverlauf: eine Hyperbel zwischen Km und Vmax
Die Sättigungsfunktion eines “Michaelis-Menten Enzyms” lässt sich unter Verwendung der Parameter Km und Vmax wie folgt formulieren[1]:
Dies ist die Michaelis-Menten Beziehung, d. h. die Gleichung einer Hyperbel mit den folgenden in der Abbildung gezeigten Eigenschaften:
- Ihre Asymptoten entsprechen den Werten Vmax (realer Ast) und Km (imaginärer Ast, gestrichelt);
- Gleicht die Substratkonzentration [S] dem Km-Wert, so liegt die Hälfte des ursprünglich vorhandenen Enzyms [Eo] in Form des Enzym-Substrat-Komplexes [ES] vor, die andere Hälfte ist frei [E].
- Da die Sättigung asymptotisch angenähert wird, sind hierzu Substratkonzentrationen erforderlich, die mehr als dem zehnfachen Km-Wert entsprechen. Im Umkehrschluss gilt: Hat man für ein Enzym eine Sättigungshyperbel gemessen, d. h. die Umsatzgeschwindigkeit v als Funktion der Substratkonzentration [S] bestimmt, so lassen sich daraus Vmax (die Aktivität) und Km (die reziproke Affinität) ableiten. Ein relativ neues, einfaches und doch präzises Verfahren zu diesem Zweck ist die direkt-lineare Auftragung (Enzymkinetik).
- Inhibitoren, darunter wichtige Medikamente und Gifte, ändern die Eigenschaften von Enzymen und können mit den hier eingeführten Methoden näher charakterisiert und in ihrer Wirkungsweise besser verstanden werden:
-
- „kompetitive“ Inhibitoren erhöhen den Km-Wert, verändern Vmax jedoch nicht
- „unkompetitive“ Inhibitoren senken sowohl den Km-Wert als auch Vmax
- Inhibitoren vom Mischtyp erhöhen den Km-Wert und erniedrigen Vmax
- als Sonderfall des Mischtyps hat der „nichtkompetitive“ Inhibitor zu gelten, der ausschließlich den Vmax-Wert senkt; bei Einsubstrat-Enzymen kommt er (entgegen verbreiteter Auffassung) nicht vor
- „nichtkompetitive“ Inhibitoren (selten anzutreffen) senken Vmax, verändern den Km-Wert aber nicht
Unter Enzymkinetik finden sich weitere Merkmale dieser Inhibitionstypen.
Einzelnachweise
- ↑ für eine Herleitung, siehe hier
Siehe auch
Wikimedia Foundation.

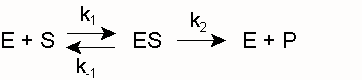



![v= {V_{max} \times [S] \over K_m + [S]}](/pictures/dewiki/49/1078e4dd27dbc54fa8ad868418dbbce1.png)